Gesetz von Boyle und Mariotte
Unter der Bedingung, dass die Temperatur eines Gases konstant ist und sich das Gas wie das ideale Gas verhält, gilt:
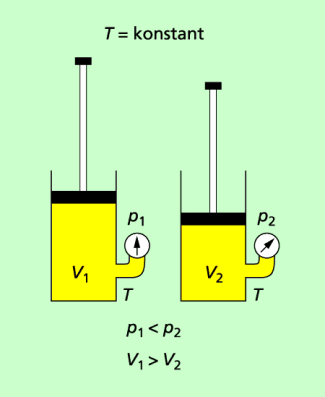
Je kleiner das Volumen eines Gases ist, desto größer ist der Druck in ihm.
Dieses Gesetz wurde erstmals 1662 von dem britischen Chemiker und Physiker ROBERT BOYLE (1627-1691) und, unabhängig davon, einige Jahre später von dem französischen Forscher EDME MARIOTTE (um 1620-1684) formuliert.
In einer Luftpumpe herrscht bei einem bestimmten Volumen der eingeschlossenen Luft ein bestimmter Druck. Wird der Kolben in den Zylinder hineingepresst, so verringert sich das Volumen. Der Druck vergrößert sich entsprechend. Es gilt:
Je kleiner das Volumen der eingeschlossenen Luft ist, desto größer ist der Druck in der Luft.
Unter der Bedingung, dass die Temperatur in einem Gas konstant ist und sich das Gas wie das ideale Gas verhält, gilt:
Dieses Gesetz wurde erstmals 1662 von dem britischen Chemiker und Physiker ROBERT BOYLE (1627-1691) und, unabhängig davon, einige Jahre später von dem französischen Forscher EDME MARIOTTE (um 1620-1684) formuliert und wird heute als Gesetz von BOYLE und MARIOTTE oder auch als Druck-Volumen-Gesetz bezeichnet. Dieses Gesetz ist ein Spezialfall der Zustandsgleichung für das ideale Gas. Da bei dem betrachteten Vorgang die Temperatur des Gases konstant bleibt, sich aber Druck und Volumen ändern, spricht man in der Physik auch von einer isothermen Zustandsänderung des Gases.
Beispiele für das Wirken des Gesetzes
Beispiele für das Wirken des Gesetzes von BOYLE und MARIOTTE treten überall dort auf, wo sich das Volumen abgeschlossener Gasmengen ändert und dabei die Temperatur näherungsweise konstant ist.
Ein Beispiel dafür sind Pumpen (Luftpumpen, Pumpen für Sauerstoff in der Medizin). Bei näherungsweise konstanter Temperatur wird das Volumen des Gases verringert. Dadurch erhöht sich der Druck in ihm. Bei einem bestimmten höheren Druck strömt das Gas in den gewünschten Raum, z. B. bei einer Luftpumpe in den Schlauch oder bei einer medizinischen Pumpe in die Lunge.
Auch bei Wasserbällen oder Luftmatratzen zeigt sich der Zusammenhang zwischen Druck und Volumen: Je mehr Luft man hineinbläst, desto größer wird der Druck. Mit Vergrößerung des Druckes vergrößert sich auch das Volumen.
-
Bei konstanter Temperatur gilt: Je kleiner das Volumen, desto größer der Druck.