Isotope
Atomkerne eines Elements mit gleicher Protonenzahl, aber unterschiedlicher Anzahl von Neutronen werden als Isotope bezeichnet. Es sind spezielle Nuklide. Wegen der gleichen Protonenzahl (= Kernladungszahl) haben Isotope auch die gleiche Anzahl von Elektronen in der Hülle.
Atomkerne eines Elements mit gleicher Protonenzahl, aber unterschiedlicher Neutronenzahl werden als Isotope bezeichnet. Es sind spezielle Nuklide. Wegen der gleichen Protonenzahl (=Kernladungszahl) haben Isotope auch die gleiche Anzahl von Elektronen in der Hülle.
Beispiele für Isotope
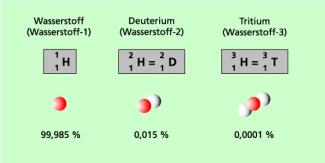
So existieren z. B. beim Wasserstoff drei in der Natur vorkommende Isotope, die als Wasserstoff, Deuterium und Tritium bezeichnet werden (Bild 1). Es gibt nur etwa 20 Elemente, die nur aus einem einzigen stabilen Isotop bestehen. Dazu gehören beispielsweise:
Die meisten Elemente bestehen aus einem Isotopengemisch, wobei die Anteile der einzelnen Isotope sehr unterschiedlich sein können. So hat z. B. Uran, das als Kernbrennstoff genutzt wird, drei in der Natur vorkommende stabile Isotope mit folgenden Anteilen bei natürlichen Uranvorkommen:
| Uran-238: Uran-235: Uran-234: | 99,28 % 0,72 % 0,006 % |
Für Brennelemente in Kernkraftwerke nutzt man angereichertes Uran mit folgender Zusammensetzung:
| Uran-235: Uran-238: | 3,3 % 96,7 % |
Bei Kupfer betragen die Anteile der stabilen Isotope:
| Kupfer-63: Kupfer-65: | 69,1 % 30,9 % |
Die meisten stabilen Isotope hat Zinn (10), die meisten Isotope überhaupt sind beim Xenon bekannt (mindestens 24).
Außer in der Neutronenzahl und damit in der Masse unterscheiden sich die Isotope eines Elements im Kernvolumen und bei leichten Elementen im chemischen Verhalten.
Stabile und radioaktive Isotope
Man kann zwischen stabilen Isotopen und radioaktiven Isotopen, auch Radioisotope oder Radionuklide genannt, unterscheiden. Radioaktive Isotope zerfallen unter Aussendung radioaktiver Strahlung. Bekannt sind heute etwa 300 stabile und über 2.400 radioaktive und damit instabile Isotope.
-
Isotope des Wasserstoffs und ihre Anteile