Biophosphoglycerat (BPG)
Nach der Entdeckung des Biophosphoglycerat (BPG) 1967 konnte erklärt werden, wie Sauerstoff vom Oxyhämoglobin in den Geweben wieder abgegeben wird. In den roten Blutzellen fand man die Substanz BPG, die in der gleichen Konzentration vorliegt wie Hämoglobin. Sie verändert den Partialdruck des Sauerstoffs um den Faktor 26, senkt die Sauerstoffaffinität im Gewebe und bewirkt damit Sauerstoffabgabe. Nach dem gleichen Mechanismus funktioniert die Sauerstoffübergabe des mütterlichen Blutes an den Fetus in der Plazenta.
Die Sauerstoffaufnahme ins Blut, seine Abgabe an die Zellen sowie der Transport des Kohlenstoffdioxides als Stoffwechselendprodukt hängen von vielen aufeinander genau abgestimmten Bedingungen ab. Zu diesen Bedingungen gehören die Partialdrucke von Sauerstoff in Lunge und Gewebe, der Bau von Hämoglobin und sein Gehalt in den Erythrozyten, der pH-Wert des Blutes sowie die Kohlenstoffdioxid-Konzentration.
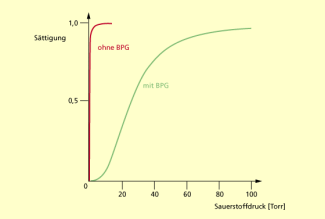
SIR JOSEPH BARCROFT (1872-1947) vermutete 1921 eine weitere Substanz, die einen integralen Bestandteil des Hämoglobin-Sauerstoff-Komplexes darstellt. 1967 wurde diese Substanz von REINHOLD UND RUTH BENESCH gefunden. Es ist die Substanz 2,3-Biophosphoglycerat - BPG. Sie wird vom Hämoglobin gebunden und übt einen großen Einfluss auf die Sauerstoffaffinität aus. BPG kommt in den roten Blutzellen in der gleichen Konzentration vor wie das Hämoglobin. Ohne BPG beträgt der Druck im Hämoglobin 1 Torr. Das ist der gleiche Wert, der auch im Myoglobin der Muskeln herrscht. Unter diesen Umständen würde Sauerstoff vom Hämoglobin nicht abgegeben. Es würde gehalten und weitertransportiert werden.
Allein durch die Anwesenheit von BPG in den roten Blutzellen steigt der Partialdruck auf 26 Torr. Das bedeutet, dass sich die Sauerstoffaffinität von Hämoglobin um den Faktor 26 vermindert. Das ist entscheidend dafür, dass Hämoglobin in den Gewebekapillaren Sauerstoff abgeben kann.BPG senkt die Sauerstoffaffinität, indem es sich an das Hämoglobin (ohne angelagerten Sauerstoff) bindet, nicht aber an das Oxyhämoglobin (mit Sauerstoff beladen). Bei Sauerstoffbindung an Hämoglobin in der Lunge wird BPG wieder freigesetzt.
-
BPG senkt die Sauerstoffaffinität des Blutes.
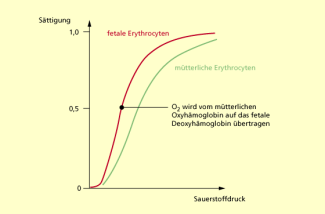
Nachdem man diese Entdeckung gemacht hatte, ließ sich auch endlich erklären, warum das mütterliche Hämoglobin Sauerstoff an den Fetus abgibt. Schon viel eher wusste man, dass ein Fetus einen anderen Hämoglobintyp, das Hämoglobin F, besitzt. Hämoglobin A ist der Typ, den ein Erwachsener hat.Eine wichtige Eigenschaft des Hämoglobin F ist seine höhere Sauerstoffaffinität im Vergleich zum Hämoglobin A. Sie war schon lange bekannt, mit der Entdeckung des BPG kannte man nun auch die Ursache.Hämoglobin F bindet BPG weniger stark als Hämoglobin A. Deshalb gibt das mütterliche Blut den Sauerstoff in der Plazenta an den fetalen Kreislauf ab.
-
Fetale rote Blutzellen haben eine höhere Sauerstoffaffinität als die der Mutter.