Johannes Diderik van der Waals
* 23.11.1837 Leiden
† 08.03.1923 Amsterdam
Er war ein niederländischer Physiker, der sich vor allem mit Flüssigkeiten und Gasen beschäftigte. Seine wahrscheinlich bedeutendste wissenschaftliche Leistung war die Aufstellung einer Gleichung für reale Gase, die heute die Bezeichnung van der waalssche Zustandsgleichung trägt. Für seine wissenschaftlichen Leistungen wurde er 1910 mit dem Nobelpreis für Physik ausgezeichnet.
JOHANNES DIDERIK VAN DER WAALS lebte in einer Zeit, in der die klassische Physik ihre endgültige Ausformung erfuhr. Das gilt auch für den Bereich der Flüssigkeiten und Gase, mit denen er sich intensiv beschäftigte. Die Gesetze für das ideale Gas waren durch Forscher wie ROBERT BOYLE (1627-1691), EDME MARIOTTE (um 1620-1684) oder JOSEPH LOUIS GAY-LUSSAC (1778-1850) gefunden worden. Offen war aber die genaue Beschreibung von realen Gasen einschließlich der Wechselwirkungen, die zwischen den Teilchen der Gase auftreten. Das war einer der Schwerpunkte, mit denen sich J. D. VAN DER WAALS vorrangig beschäftigte.
Leben und Wirken
JOHANNES DIDERIK VAN DER WAALS wurde am 23. November 1837 in der Universitätsstadt Leiden geboren. Nach Schulbesuch und Studium der Physik war er ab 1864 zunächst als Lehrer an einer Schule und auch als Schuldirektor tätig. Schon in dieser Zeit beschäftigte er sich mit physikalischen Problemen, insbesondere mit Flüssigkeiten und Gasen. 1873 legte er an der Universität Leiden seine Doktorprüfung ab. Der Titel seiner Doktorarbeit lautete: „Die Kontinuität des gasförmigen und flüssigen Zustands“.
Seine ersten Forschungen führte VAN DER WAALS neben seiner beruflichen Tätigkeit aus. Dass er überhaupt zur Doktorprüfung zugelassen wurde, verdankte er einem neuen niederländischen Gesetz, das Doktoranden der Naturwissenschaften von den bis dahin obligatorischen Prüfungen in Altgriechisch und Latein befreite.
Seine ersten wissenschaftlichen Arbeiten fanden eine solche Beachtung, dass er 1877 als Professor auf den Lehrstuhl für Physik an der neu gegründeten Universität Amsterdam berufen wurde. Auf wissenschaftlichem Gebiet beschäftigte er sich vorrangig mit Flüssigkeiten und Gasen und den Phasenübergängen, aber auch mit der Oberflächenspannung und der Kapillarität . In Amsterdam war er bis zu seiner Emeritierung im Jahre 1908 tätig. 1910 erhielt er für sein wissenschaftliches Werk den Nobelpreis für Physik. JOHANNES DIDERIK VAN DER WAALS starb am 8. März 1923 in Amsterdam.
Wissenschaftliche Leistungen
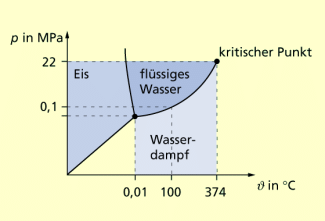
Im Zusammenhang mit der Entwicklung und Verbesserung von Dampfmaschinen wurden auch zahlreiche Untersuchungen zum Phasenübergang flüssig-gasförmig von Wasser durchgeführt. Dabei zeigte sich, dass die Zustandsgleichung für das ideale Gas die Verhältnisse in der Nähe des Übergangspunkts, des kritischen Punkts, nicht richtig beschrieb.
In seiner Doktorarbeit verallgemeinerte VAN DER WAALS 1873 die Zustandsgleichung so, dass er das Volumen der Gasmoleküle berücksichtigte und darüber hinaus die anziehenden Kräfte ( VAN DER WAALS-Kräfte ) mit einbezog, die die Moleküle aufeinander ausüben und die den Druck beeinflussen. Diese Anziehungskräfte entstehen dadurch, dass Atome äußerst kurzlebige Dipole bilden können. Die eine Seite des Atoms weist dann eine etwas stärker negative Ladung auf als die andere (unsymmetrische Ladungsverteilung). Die Möglichkeit zur Polarisierung nimmt mit steigender Oberfläche des Atoms zu und ist umso größer, je weiter die äußeren Elektronen vom Kern entfernt sind. Aus diesem Grund nehmen die Van-der-Waals-Kräfte mit steigender Atom- bzw. Molekülmasse zu.
Die mit der Gleichung durchgeführten Berechnungen stimmten mit den experimentellen Ergebnisse überein. Diese Zustandsgleichung für reale Gase wird heute als Zustandsgleichung von van der Waals oder als van der waalssche Zustandsgleichung bezeichnet. Sie lautet:
Von sehr großer Bedeutung waren die Ergebnisse seiner Untersuchungen vor allem für die sich in dieser Zeit schnell entwickelnde Tieftemperaturphysik.
Darüber hinaus fand VAN DER WAALS 1880 das Gesetz der korrespondierenden Zustände . Dieses Gesetz besagt: Die Zahlenwerte von Druck, Volumen und Temperatur können zwar für verschiedene Stoffe am kritischen Punkt unterschiedlich sein. Die verschiedenen Stoffe verhalten sich aber gleich, wenn alle Messgrößen auf die jeweiligen kritischen Werte bezogen werden.
-
Phasendiagramm für Wasser mit dem Tripelpunkt und dem kritischen Punkt