Komplexometrie
Die Komplexometrie hat sich in den letzten Jahren zu einem wichtigen quantitativen Analyseverfahren der Chemie in Forschung und Industrie entwickelt, denn sie besticht durch sehr genaue Ergebnisse und ihre einfache und vielseitige Anwendung. In diesem Abschnitt wird die Komplexometrie genauer vorgestellt, indem das zugrundeliegende Verfahren und verschiedene Titrationsmethoden beschrieben werden.
Die Komplexometrie ist eine quantitative Bestimmungsmethode für zahlreiche mehrwertige Kationen in wässrigen Lösungen. Sie beruht auf der Bildung wasserlöslicher, sehr stabiler Komplexe aus organischen Chelatbildnern und Metall-Ionen. Aufgrund der Überführung der Kationen in Chelatkomplexe ist ebenso der Begriff Chelatometrie in der Literatur zu finden. Bei Chelatliganden handelt es sich um organische Moleküle, die in einem geeigneten räumlichen Abstand zwei oder mehr funktionelle Gruppen mit freien Elektronenpaaren besitzen, die als Lewis-Basen (Elektronenpaar-Donatoren) zur Ausbildung koordinativer Bindungen fähig sind.
Die Stabilität von Chelatkomplexen
Generell gilt, dass Chelatkomplexe stabiler sind als Komplexe mit vergleichbaren einzähnigen Liganden. Dieser sogenannte Chelateffekt hat kinetische und thermodynamische Ursachen. Die Stabilität der Komplexe wird durch die Komplexbildungskonstante angegeben. Besonders stabile Chelatkomplexe bilden sich, wenn die funktionellen Gruppen im Liganden so verteilt sind, dass sich bei der Komplexbildung möglichst viele Fünf- oder Sechsringe um das Metall-Ionen ausbilden können, da diese energetisch besonders günstig sind.
Komplexometrische Titrationen
Komplexometrische Analysen werden in der Regel als Titrationen (Bild 2) durchgeführt. Damit eine Komplexbildungsreaktion für die quantitative Analyse geeignet ist, müssen mehrere Bedingungen erfüllt sein.
Wie bei allen anderen Titrationen ist eine exakte stöchiometrische Umsetzung zwingend nötig, und das Gleichgewicht muss unter den Reaktionsbedingungen vollständig auf der Seite der Produkte liegen.
Weil viele Chelatbildner, wie z. B. Natriumedetat, bei der Chelatisierung mit Metall-Ionen Protonen abgeben, welche den pH-Wert der Lösungen verringern, der pH-Wert sich im Laufe der Titration aber nicht ändern sollte, damit es nicht zu unerwünschten Gleichgewichtsverschiebungen kommt, müssen die Lösungen entsprechend gepuffert sein.
Unter Verwendung mehrzähniger Chelatbildner lässt sich der Gehalt von fast allen mehrwertigen Metall-Ionen in wässrigen Lösungen exakt bestimmen, wenn
- die Komplexbildung in einem Schritt erfolgt,
- die Reaktionsgeschwindigkeit groß genug ist,
- der Komplex sehr stabil ist, d. h. eine große Komplexbildungskonstante hat, und
- ein geeigneter Indikator vorhanden ist.
Die Komplexometrie lässt sich ohne Schwierigkeiten und mit geringem Zeitaufwand und ohne komplizierte Apparaturen im Makro-, Halbmikro- und Mikro-Arbeitsbereich anwenden.
Der heutzutage in der Komplexometrie hauptsächlich verwendete Chelatbildner ist die Ethylendiamintetraessigsäure kurz auch EDTA genannt. Es löst sich leicht in Wasser, ist kaum hygroskopisch und reagiert mit allen mehrwertigen Metall-Ionen im Verhältnis 1:1, wobei das Metall-Ion oktaedrisch koordiniert wird (Bild 2). Wegen seiner großen Bedeutung wird hier nur das Natriumedetat als Komplexbildner besprochen und alle Erklärungen auf dieses Salz bezogen.
Titrationsmethoden
In der Komplexometrie kann man verschiedene Titrationsmethoden unterscheiden, die direkte, die indirekte oder die substituierende Titration. Welche der Methoden angewendet wird, hängt einerseits davon ab, bei welchem pH-Wert das zu bestimmende Metall-Ion als Hydroxid ausfällt und andererseits davon, ob ein geeigneter Indikator verfügbar ist.
pH-Wert und Puffer
Der pH-Wert spielt bei der Komplexometrie eine wichtige Rolle, weil er maßgeblich die Bildung von Komplexen beeinflusst. Veränderungen des pH-Wertes führen daher zu veränderten Bedingungen für die Titration, wodurch ihre Genauigkeit abnimmt.
Der pH-Wert und die Komplexbildung hängen eng zusammen, weil Liganden aufgrund ihrer freien Elektronenpaare auch als Basen wirken können. Im sauren Milieu, d. h. bei niedrigen pH-Werten, konkurrieren somit Wasserstoff-Ionen und Metall-Ionen um die Liganden, und die Komplexbildung wird erschwert. Ein hoher pH-Wert, bei dem nur wenige Wasserstoff-Ionen in der Lösung vorliegen, wirkt sich also positiv auf die Komplexbildung aus. Ein hoher pH-Wert ist jedoch auch nachteilig, weil viele Metall-Ionen im alkalischen Milieu als Hydroxide ausfallen und somit keine Komplexe mehr bilden können.
Hinzu kommt, dass viele organische Liganden selbst Säuren sind und bei der Komplexbildung Protonen abgeben, was zu einer Erniedrigung des pH-Wertes führt.
Beispiel:
Ein weiteres Problem ist, dass die Farbe mancher Indikatoren pH-abhängig ist, sie haben also bei niedrigerem pH-Wert eine andere Farbe als bei hohem pH-Wert. Dies kann dazu führen, dass der Farbumschlag des Indikators, der den Äquivalenzpunkt der Titration anzeigt, nicht mehr deutlich zu sehen ist.
Um einen gleichbleibenden pH-Wert und somit gleichbleibende Titrationsbedingungen zu garantieren, muss die Lösung daher gepuffert werden. Die Wahl eines geeigneten pH-Wertes und somit eines Puffers für die Komplexometrie ist aber, wie aus dem Gesagten erkennbar ist, nicht ganz einfach.
Indikatoren
Bei den in der Komplexometrie verwendeten Indikatoren handelt es sich ebenfalls um Komplexliganden, die farbige, weniger stabile Komplexe mit dem zu bestimmenden Metall-Ion bilden als der Ligand, der zur Titration verwendet wird (meist EDTA).
In der zu titrierenden Lösung liegen die Metall-Ionen zum Teil frei, zum Teil als Metall-Indikator-Komplex vor. Bei Zugabe von EDTA werden nach und nach die freien Metall-Ionen komplexiert. Der Umschlagspunkt der Titration (Äquivalenzpunkt) ist erreicht, wenn keine freien Metall-Ionen in der Lösung mehr vorliegen und nun noch etwas EDTA zugegeben wird. In diesem Moment werden die Metall-Ionen aus dem Metall-Indikator-Komplex gelöst, es bildet sich der stabilere Metall-EDTA-Komplex. Der freie Indikator hat eine andere Farbe als der Metall-Indikator-Komplex und zeigt so den Äquivalenzpunkt an.
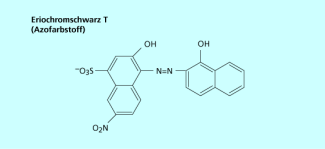
Ein häufig verwendeter Indikator ist Eriochromschwarz T (Erio T, Bild 3). Seine Farbe ist pH-abhängig:
Die Titration wird in der Regel bei pH = 10 durchgeführt. Bei diesem Wert hat der Indikator eine tiefblaue Farbe.
Direkte Titration
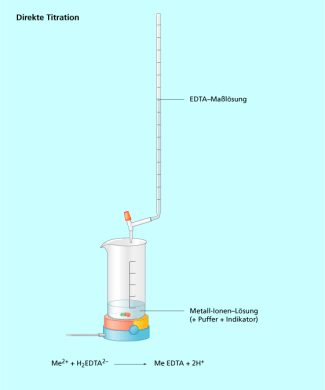
Bei der direkten Titration wird die zu untersuchende Lösung mit einer EDTA-Maßlösung titriert (Bild 4). Dies ist bei vielen Metall-Ionen, wie z. B. möglich. Die bei der Titration freiwerdenden Wasserstoff-Ionen werden mit einem zugegebenen Puffer abgefangen. Citrat- und Tartrat-Puffer sind ebenfalls einsetzbar, da sie durch Bildung schwacher Komplexe die Metall-Ionen vor dem Ausfallen schützen.
Als Indikator wird häufig das bereits erwähnte Erio T verwendet.
Gibt man Erio T zu einer Lösung, die Metall-Ionen enthält, so bildet sich der Metall-Indikator-Komplex, der meistens rot gefärbt ist. Am Äquivalenzpunkt werden die Metall-Ionen aus diesem Komplex verdrängt, und es zeigt sich die tiefblaue Farbe des freien Indikators.
Indirekte Titration
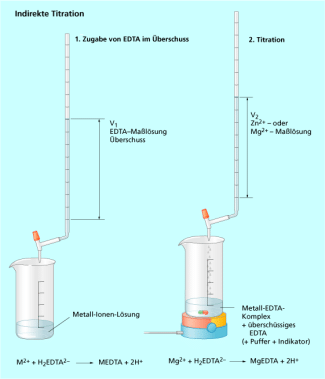
Ist es nicht möglich, einen für die Titration nötigen pH-Wert einzustellen, ohne dass Metallhydroxide ausfallen, oder fehlt ein geeigneter Indikator, wählt man meist die Methode der indirekten Titration (Bild 5). Zu der Metall-Ionen-Lösung wird eine bestimmte Menge einer EDTA-Lösung bekannter Konzentration in geringem Überschuss zugegeben, sodass alle Metall-Ionen von EDTA komplexiert vorliegen. Danach wird durch Zugabe der Pufferlösung der gewünschte pH-Wert eingestellt, was nun möglich ist, da aufgrund der Komplexbildung keine Metallhydroxide ausgefällt werden. Anschließend wird ein geeigneter Indikator zugegeben und das überschüssige EDTA mit einer Zink- oder Magnesiumlösung bekannter Konzentration zurücktitriert. Hierbei bildet sich zunächst der stabilere Metall-EDTA-Komplex, während der Indikator frei in Lösung vorliegt. Sobald alles EDTA reagiert hat, wird der Metall-Indikator-Komplex gebildet, und es kommt zum Farbumschlag des Indikators.
Die Rücktitration eignet sich vor allem zur Bestimmung von
Bestimmung der Wasserhärte als Beispiel für eine komplexometrische Titrationen
Die Wasserhärte wird durch Calcium- und Magnesium-Ionen verursacht. Ihr Gehalt im Wasser kann komplexometrisch bestimmt werden.
Hierfür wird zuerst die Gesamthärte, d.h. die Gesamtkonzentration an Magnesium- und Calcium-Ionen, durch Titration mit EDTA in einer ammoniakalischen Lösung bei pH 10 ermittelt.
Um die Konzentration der Calcium-Ionen zu bestimmen, wird eine zweite Probe mit Natronlauge versetzt, bis ein pH-Wert von 13 erreicht ist. Unter diesen Bedingungen liegen die Magnesium-Ionen als schwer lösliches vor, das mit EDTA nicht reagiert.
Die Calcium-Ionen liegen weiterhin gelöst vor, und ihre Konzentration kann durch Titration mit EDTA bestimmt werden.
Nach Durchführung der beiden Schritte kennt man die Gesamtkonzentration an Calcium- und Magnesium-Ionen und die Konzentration der Calcium-Ionen. Aus der Differenz des EDTA-Verbrauchs bei den beiden Titrationen kann in der Lösung die Konzentration der Magnesium-Ionen ermittelt werden.
Quantitatives und Qualitatives
Die Komplexometrie eignet sich gut dazu, um die Menge an Metall-Ionen in einer Lösung zu bestimmen. Von Vorteil ist immer, wenn keine anderen Metall-Ionen außer den zu untersuchenden in der Lösung vorliegen, weil anderenfalls Nebenreaktionen ablaufen können. Befinden sich in der Lösung störende Begleiter, ist es durch Maskierungsreaktionen unter Umständen möglich, diese an der Reaktion zu hindern, so können z. B. Eisen-Ionen durch Zugabe von Kaliumcyanid in die stabilen und somit äußerst stabilen Cyanidkomplexe überführt werden.
Häufig wird die Bestimmung der Gesamthärte in Leitungswasser durch Cu(II)-Ionen gestört. Diese gelangen in das Leitungswasser durch Korrosion der Wasserleitungsrohre aus Kupfer in für Menschen unschädlichen Konzentrationen von 0,1 bis etwa 1 mg/l.
Sie bilden mit dem Indikator Erio T einen stabileren Komplex als Calcium und Magnesium und er ist auch stabiler als der Cu-EDTA-Komplex. Somit ist der Indikator blockiert und es erfolgt kein Farbumschlag bei der Titration. Durch Zugabe von Natriumdiethyldithiocarbaminat anstelle der (auch möglichen) giftigen Cyanid-Ionen werden die störenden Kupfer-Ionen maskiert. Der Indikator steht nun für die Komplexierung der Calcium- und Magnesium-Ionen zur Verfügung.
Quantitative Untersuchungen in der Komplexometrie können mithilfe der Titration, Fotometrie oder Fluoreszenzmessung erfolgen.
In manchen Fällen kann die Komplexbildung auch für die qualitative Analyse herangezogen werden, denn einige Metall-Ionen bilden charakteristische Farbkomplexe, z. B. grüngelbes Magnesiumoxinat oder rotviolettes Nickeldimethylglyoxim.
Qualitative Nachweise durch Komplexbildung - Beispiele aus der Bioanalytik:
Mithilfe von Metall-Ionen (meist Übergangsmetall-Ionen) können Biomoleküle und ~polymere wie z. B. Peptide und Kohlenhydrate nachgewiesen werden.
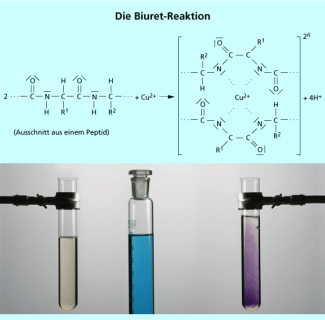
Die Biuret-Reaktion , die im alkalischen Milieu mit Kupfer(II)-sulfatlösung als Nachweisreagens durchgeführt wird, dient zum Nachweis der Peptidbindung. Hierbei wird ein violetter Komplex gebildet, bei dem die Stickstoffatome in der Peptidkette als Haftatome fungieren (Bild 6).
-
Heinz Mahler - H. Mahler, Fotograf, Berlin
Die fehlingsche Probe dient zum Nachweis von reduzierenden Stoffen, z. B. von Kohlenhydraten wie Glucose, die in der Kettenform eine Aldehydgruppe enthält. Das hierfür verwendete Nachweisreagens besteht aus zwei Komponenten, einer Lösung von Kupfer(II)-sulfat (fehlingsche Lösung 1) und einer alkalischen Lösung von Natriumkaliumtartrat, einem Salz der Weinsäure (fehlingsche Lösung 2). Beim Mischen ergeben sie einen tiefblauen Kupfer(II)-Ditartrat-Komplex, dessen Bildung die Fällung von Kupferhydroxid verhindert. Dieser Komplex wird zerstört, wenn reduzierende Verbindungen, z. B. Aldehyde, in der Lösung sind. Bei der Oxidation der in der Glucose enthaltenen Aldehydgruppe wird reduziert, welches nicht mehr als Zentral-Ion für den Tartrat-Komplex geeignet ist. fällt im Basischen als ziegelrotes aus.
Suche nach passenden Schlagwörtern
- qualitative Analyse
- Komplexometrie
- Biuret-Reaktion
- Substitutionstitration
- Chelatliganden
- EDTA
- quantitative Analyse
- direkten Titration
- Chelateffekt
- Indikatoren
- indirekten Titration
- Chelatometrie
- Erio T
- Ethylendiamintetraacetat
- Komplexbildungskonstante
- Chelatbildnern
- fehlingsche Probe
- Titration
- Bioanalytik
- Ethylendiamintetraessigsäure
- Rechenbeispiel
- Animation
- Titrationsmethoden