Orbitale – Erläuterung, Besetzungsregeln, Beispiel
Um den Bau der Atome zu veranschaulichen, gibt es sehr unterschiedliche Modelle. Zur Verdeutlichung wie sich die Elektronen in einer Atomhülle verteilen, wurde die modellhafte Theorie von den Orbitalen entwickelt. Orbitale beschreiben den wahrscheinlichen Aufenthaltsort der einzelnen Elektronen und ermöglichen so die Vorstellung von bestimmten räumlichen Anordnungen, vor allem, wenn die Atome chemische Bindungen eingehen.
Ein Atom wird in Atomkern und Atomhülle gegliedert.
Die Hülle kann dabei vereinfacht als aus Schalen bestehend betrachtet werden. Die Schalen entsprechen bestimmten Energiestufen (Energieniveaus).
Bei der Erklärung bestimmter Reaktionen, besonders bei Reaktionen der Nebengruppenelemente und der Elemente mit einer Ordnungszahl, die höher ist als 20, stößt dieses vereinfachte Modell an Grenzen.
Auch die Frage, warum ein Element unterschiedliche Oxide bilden kann, lässt sich damit nicht beantworten.
Im Orbitalmodell werden die Aufenthaltsräume der Elektronen („Hauptniveaus“) in einzelne Bereiche – die Orbitale – aufgeteilt. Dabei ist die Anzahl der Orbitale umso größer, je weiter das Hauptniveau vom Atomkern entfernt ist.
So umfasst die erste (K-) Schale nur ein Orbital – das s-Orbital –, die zweite (L-) Schale schon vier Orbitale – ein s-Orbital und drei p-Orbitale – die dritte (M-) Schale 9 Orbitale – ein s-Orbital, drei p-Orbitale und fünf d-Orbitale usw.
Orbitale
Ein Orbital beschreibt einen bestimmten Bereich (Raum) um einen oder um mehrere Atomkerne, in dem sich ein Elektron mit einer Wahrscheinlichkeit von ungefähr 90 % aufhält.
Die genaue „Bahnkurve“ des Elektrons kann nicht ermittelt werden.
Aber entsprechend der Aufenthaltswahrscheinlichkeit des Elektrons kann man eine Elektronendichte angeben.
Der mögliche Raum, in dem das Elektron sich aufhalten kann, wird durch die Form der jeweiligen Orbitale beschrieben.
Jedes Elektron besitzt einen bestimmten Energiegehalt, aus dem sich die unterschiedliche räumliche Form des Orbitals ergibt, die aber immer symmetrisch ist.
Für das Wasserstoffatom, das als einziges Element nur ein Elektron besitzt, hat man eine kugelsymmetrische Verteilung der Elektronendichte festgestellt.
In allen anderen Atomen beeinflussen sich die Elektronen gegenseitig, sodass es schwer ist, ihren Aufenthaltsort zu erfassen. Man kann aber die näherungsweise erworbenen Zusammenhänge auf die anderen Atome übertragen.
s-Orbitale
Zu jeder Hauptenergiestufe (Schale) gehört ein kugelsymmetrisches Orbital, welches man durch ein „s“ kennzeichnet. Die Größe dieses s-Orbitals richtet sich nach der Schale, der es zuzuordnen ist. Sie nimmt mit steigender Zahl (n) zu.
-
Kugelförmiges s-Orbital
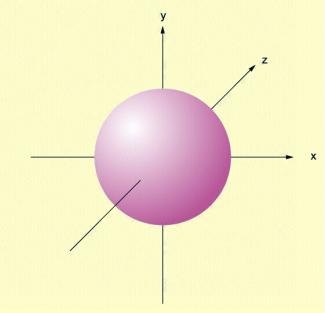
p-Orbitale
Auf dem zweiten Energieniveau (n=2) und auf jedem darauffolgenden gibt es drei sogenannte p-Orbitale, die alle den gleichen Energiegehalt, sowie die gleiche Größe und Form aufweisen. Diese Orbitale sind hantelförmig und stehen senkrecht aufeinander, sie sind also räumlich gerichtet. Man bezeichnet sie auch als px- , py- und pz-Orbitale, die man in einem Koordinatensystem darstellen kann.
Sie werden modellhaft als symmetrische, um die jeweiligen Achse rotierende Gebilde betrachtet.
d-Orbitale
Ab dem dritten Hauptniveau (n=3) gibt es zusätzlich noch fünf d-Orbitale, von denen vier rosettenförmig sind und eins hantelförmig, wie ein p-Orbital nur mit einem zusätzlichen Ring.
f-Orbitale
Die f-Orbitale werden bei den Lanthanoiden und den Actinoiden mit Elektronen besetzt. Von ihnen gibt es sieben.
Ihre Form ist sehr kompliziert und noch nicht vollständig klar.
Verteilung der Elektronen in der Atomhülle
Für die Verteilung von Elektronen eines Atoms auf die jeweiligen Orbitale der Atomhülle gibt es festgelegte Regeln.
- In (neutralen) Atomen entspricht die Elektronenanzahl der Anzahl der Protonen im Atomkern und der Ordnungszahl.
- PAULI-Prinzip : In jedem Orbital befinden sich maximal zwei Elektronen, da die Elektronen in einem Orbital immer mindestens durch eine Eigenschaft unterscheidbar sein müssen, was in diesem Fall der sogenannte Elektronenspin (Drehrichtung der Elektronen) ist, von dem es nur zwei Möglichkeiten gibt.
- Bei der Verteilung der Elektronen auf die Orbitale wird jeweils zuerst das energieärmste noch freie Orbital besetzt.
Orbitale der gleichen Energiestufe werden zunächst einfach besetzt. Erst wenn alle Orbitale einer Hauptenergiestufe ein Elektron haben, wird ein Orbital doppelt besetzt (HUNDsche Regel).
Darstellung der Besetzung
Es gibt zwei Arten, um die Orbitalbesetzung eines Atoms zu beschreiben: eine Darstellung durch Zahlen und eine grafische Darstellung.
Beschreibung durch Zahlen
Beispiel:
Das Aluminiumatom (Al) hat drei Schalen (n=3, dritte Periode). Insgesamt besitzt es dreizehn Elektronen, die sich wie folgt auf die Orbitale verteilen:
(gesprochen: eins-s-zwei, zwei-s-zwei, zwei-p-sechs, drei-s-zwei, drei-p-eins).
Die Elektronen verteilen sich also auf drei kugelförmige s-Orbitale (1s, 2s, 3s), welche vollbesetzt sind und vier hantelförmige p-Orbitale , von denen drei vollbesetzt sind und eins einfach besetzt ist.
Die Zahl (1, 2, ...) gibt dabei die jeweilige Hauptschale an. Der kleine Buchstabe (s, p, ...) beschreibt die Art des jeweiligen Orbitals und die hochgestellte Zahl die Anzahl der Elektronen, die sich in dem Orbital befinden.
Grafische Darstellung (Kästchenschema)
Hier werden die Orbitale als Kästchen dargestellt, die durch Pfeile (Elektronen) besetzt werden. Die Richtung der Pfeile gibt den spin (die Drehrichtung der Elektronen) an.
![]()
-
Hantelförmige p-Orbitale


