Amphoterie
Als Amphoterie bezeichnet man die Erscheinung, bei der ein Stoff in Abhängigkeit vom Reaktionspartner als Säure oder als Base reagieren kann.
Stoffe, die sowohl Protonen abgeben, als auch Protonen aufnehmen können, nennt man Ampholyte. Ob sie als Säure oder als Base reagieren, hängt vom jeweiligen Reaktionspartner ab.
Als Amphoterie bezeichnet man die Erscheinung, bei der ein Stoff nach der Brönsted-Theorie in Abhängigkeit vom Reaktionspartner als Säure oder als Base reagieren kann. Das Wort amphoter stammt aus dem Griechischen (griech. amphoteros = beiderlei, zwitterhaft).
Ampholyte sind Verbindungen, die sowohl als Säuren (Protonendonator) aber auch als Basen (Protonenakzeptor) reagieren können. Sie werden auch als amphotere Verbindungen bezeichnet.
Ampholyte verhalten sich gegenüber starken Säuren als Basen aber gegenüber starken Basen als Säuren. Deshalb ist es verständlich, dass sie zwischen den starken Säuren und Basen liegen und darüber hinaus in der Lage sind, sowohl Protonen abzugeben als auch aufzunehmen. Typische amphotere Verbindungen oder Ionen sind daher unter den schwachen Basen und Säuren zu finden.
![]()
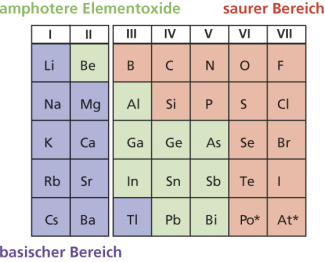
Darüber hinaus sind auch die Oxide der leichteren Elemente der II. und III. Hauptgruppe sowie der schwereren Elementen der IV. und V. Hauptgruppe Amphotere. So reagiert z. B. nicht zu hoch erhitztes AlO sowohl mit starken Säuren als auch mit starken Basen:
Im ersten Fall reagiert Aluminiumoxid als Base unter Aufnahme von Protonen und bildet dabei die korrespondierende Säure [Al(HO)]. Im zweiten Fall reagiert Aluminiumoxid als Säure unter Bildung der korrespondierenden Base [Al(OH)]. Im Neutralbereich, pH ≈ 7, sind diese Oxide meistens sehr schwer löslich, lösen sich aber im sauren wie im basischen Milieu unter Bildung ihrer hydratisierten Kationenkomplexe bzw. Bildung ihrer anionischen Hydroxometallate. In gleicher Form reagieren die anderen amphoteren Elementoxide. Diese trennen die stark basischen Oxide, welche von den elektropositiven Elementen auf der linken Seite des PSE gebildet werden, und die ausgesprochen sauren Oxide, die von den elektronegativeren Elementen auf der rechten Seite des PSE gebildet werden.
Auch die meisten Übergangsmetalloxide sind in Abhängigkeit von der Oxidationszahl des Metalls Amphotere.
Als Redox-Amphotere werden Reaktanden bezeichnet, die je nach Reaktionspartner sowohl als Oxidationsmittel, als auch als Reduktionsmittel wirken können.
Ein Beispiel für Redox-Amphoterie ist das Wasserstoffperoxid. In der Reaktion mit Iod ist die Verbindung ein Oxidationsmittel.
H2O2 + 2 I- –→ I2 + 2 OH-
Der Sauerstoff in der Oxidationsstufe -I wird zur Oxidationsstufe -II im Hydroxidion reduziert.
In der Reaktion mit Permanganat hingegen:
5 H2O2 + 2 MnO4 - + 6 H3O+ –→ 5 O2 + 2 Mn2+ + 14 H2O
ist Wasserstoffperoxid ein Reduktionsmittel, denn der Sauerstoff wird von der Stufe -I zur Stufe 0 im molekularen Sauerstoff oxidiert.
-
Elemente, die amphotere Oxide bilden (PSE-Ausschnitt)