Born-Haber-Kreisprozess
Der BORN-HABER-Kreisprozess ist nach den deutschen Forscher MAX BORN und FRITZ HABER benannt worden. Er ist ein Spezialfall des aus der Thermodynamik bekannten Satzes von HESS und dient der Berechnung von experimentell nicht oder nur schwer zugänglichen Energien. Mit dem BORN-HABER-Kreisprozess können beispielsweise Gitterenergien von Salzen oder Elektronenaffinitäten von Elementen auf mathematischem Wege ermittelt werden.
Der BORN-HABER-Kreisprozess wurde von dem deutschen Chemiker FRITZ HABER und dem deutschen Physiker MAX BORN auf der Grundlage des Satzes von HESS entwickelt. Danach ist die Enthalpie einer Bruttoreaktion gleich der Summe aller Reaktionsenthalpien der Teilschritte, in die die Gesamtreaktion zerlegt werden kann.
BORN und HABER wendeten diesen Satz speziell zur Berechnung der Gitterenergien von Ionenverbindungen an (Bild 1). Auch zur Berechung von Elektronenaffinitäten von Elementen wird dieses Schema benutzt, da diese experimentell schwer ermittelbar ist. Die Elektronenaffinität ist ein Maß dafür, wie stark Elementatome ein zusätzliches Elektron binden können. Außerdem können mit dem BORN-HABER-Kreisprozess Vorraussagen zur Stabilität hypothetischer Verbindungen getroffen werden. So wurden die Edelgasverbindungen bereits vor ihrer Synthese über Stabilitätsabschätzungen mithilfe des BORN-HABER-Kreisprozesses als stabil vorausgesagt.
Die Gitterenergie ist indirekt experimentell über kalorimetrische oder spektroskopische Messungen bestimmbar und ist ein Maß für die Stärke der Bindungen zwischen den Ionen in einem Kristallgitter. Sie wird bestimmt durch die Ladung und die Größe der Ionen im Gitter und in kJ/mol angegeben.
Bildet sich aus einem mol Kationen und einem mol Anionen eine kristalline Substanz der Zusammensetzung AB, so wird bei der Bildung des Kristalls diese Gitterenergie frei. Je größer der numerische Wert der Gitterenergie ist, desto stabiler ist der Ionenkristall. Das drückt sich häufig in einem hohen Schmelzpunkt und oft in einer großen Härte aus.
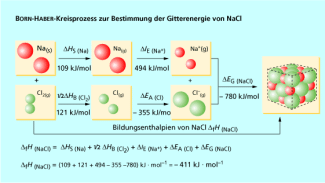
Die Bildung des Ionengitters von Kochsalz z. B. kann gedanklich in mehrere Teilschritte zerlegt werden. Dabei müssen sowohl die auftretenden energetischen Veränderungen als auch die Abläufe auf atomarer Teilchenebene berücksichtigt werden (Bild 1).
| 1. | Überführung der Elemente in freie Atome: Zu diesem Zweck muss das feste Natrium verdampft werden, um in der Gasphase Natriumatome zu erhalten. Dieser Vorgang heißt Sub-limation und erfordert das Aufbringen der Sublimationsenthalpie . Die gasförmigen Chlormoleküle müssen in Chloratome zerlegt werden, wobei die Bindungsenthalpie des Chlors aufgebracht werden muss. |
| 2. | Zur Ionisierung der freien Atome muss für die Elektronenabgabe (Bildung des Natriumkations) die Ionisierungsenergie bereitge-stellt werden. Das Chloratom nimmt das frei werdende Elektron auf und wird zum Chlorid-Anion. Die Energieänderung bei diesem Pro-zess nennt man Elektronenaffinität . |
| 3. | Aufgrund der Anziehungskräfte zwischen den unterschiedlich gela-denen Ionen wird das feste Natriumchlorid als Ionengitter gebildet. Der bei diesem Prozess frei werdende, sehr große Energiebetrag wird als Gitterenergie bzw. Gitterenthalpie bezeichnet. |
Die Bildung von Ionenkristallen aus den Elementen ist insgesamt ein exothermer Prozess. Die Ursache dafür ist hauptsächlich die Gitterenergie, die auch die Energie für die endothermen Teilschritte der Reaktion aufbringt.
Die Gitterenergie eines Salzes einer bestimmten Struktur ist umso größer, je höher geladen die Kationen und Anionen sind und je kleiner der kürzeste Abstand der Kationen und Anionen ist.
| Gitterenergie einer Verbindungen die den NaCl-Gittertyp aufweisen in [kJ/mol] | ||
| NaCl -788 | KCl -706 | NaBr -737 |
| NaI -687 | NaF -910 | MgO -3930 |
Bilden Substanzen verschiedene feste Modifikationen, so wird für jede der Modifikation eine spezifische Gitterenergie ermittelt. Das heißt die Gitterenergie ist nicht nur von der Art der Ionen abhängig, die miteinander wechselwirken, sondern auch von der Art und Weise ihrer Anordnung.
So unterscheiden sich die Gitterenergien der beiden Modifikationen des Zinksulfides ZnS (Wurtzit und Zinkblende) um 12 kJ/mol.
Der BORN-HABER-Kreisprozess ist nicht die einzige wissenschaftliche Leistung, der beiden deutschen Forscher.
-
Born-Haber-Kreisprozess zur Bestimmung der Gitterenergie
FRITZ HABER wurde am 09.12.1868 in Breslau, Deutschland geboren. Die chemischen Grundlagen der technischen Ammoniaksynthese gehen auf FRITZ HABER zurück. Dafür erhielt er 1918 den Nobelpreis für Chemie.
Nach Machtantritt der Nazis 1933 musste der jüdische Kaufmannssohn FRITZ HABER Deutschland wegen seiner Abstammung verlassen. Ein Jahr später, am 29.01.1934, starb er in Basel.
-
FRITZ HABER (1868-1934)

MAX BORN wurde am 11.12.1882 in Breslau geboren.
Er war ein deutscher Physiker und gilt als einer der bedeutendsten Physiker des 20. Jahrhunderts. Er befasste sich mit der Relativitätstheorie, der Gittertheorie der Kristalle und der elektromagnetischen Wellentheorie des Lichtes. 1954 erhielt MAX BORN gemeinsam mit WALTER WILHELM GEORG BOTHE den Nobelpreis für Physik für seine statistische Interpretation der Quantenmechanik und seine Beiträge zur Kristallphysik.
1915 veröffentlichte MAX BORN das Buch „Dynamik der Kristallgitter“. 1923 erschienen die Monografie unter dem Titel: „Atomtheorie des festen Zustandes“. Hier legte MAX BORN die Gitterdynamik in einheitlicher und wissenschaftlicher Form dar. Damit war ein Grundstein für die Festkörperphysik gelegt.
MAX BORN starb am 05.01.1970 in Göttingen.

