Gewinnung von Metallen durch Röst- und Reduktionsprozesse
Fast alle Metalle sind so unedel, dass sie in der Natur nicht elementar, sondern in Form ihrer Erze, z. B. als Oxide oder Sulfide vorliegen. Durch Anwendung bestimmter Verfahren können die Metalle aus ihren Erzen gewonnen werden. So wird beispielsweise Blei in einem Röstreduktionsverfahren aus dem sulfidischen Erz Bleiglanz gewonnen.
Sulfidische Erze sind außerdem als Rohstoff für die Schwefelsäuresynthese von Bedeutung. Aus ihnen werden – ebenfalls durch Röstprozesse – Schwefelverbindungen wie Metallsulfate oder Schwefeldioxid gewonnen, die sehr gut weiterverarbeitet werden können.
Nur sehr edle Metalle wie Gold oder Silber kommen in der Natur in metallischer Form vor. Die meisten Metalle sind vielfach als Oxide, Carbonate oder Sulfide in den Erzen enthalten. Besonders die Schwermetalle sind häufig als sulfidische Erze zu finden.
Bedeutung
In der Metallurgie röstet man die sulfidischen Erze, um aus ihnen Schwefeldioxid und das Metall, meist als Metalloxid, zu erhalten. Schwefeldioxid wird zur Schwefelsäuresynthese verwendet, die entstehenden Metalloxide werden dann zu den entsprechenden Metallen reduziert. Das Rösten ist ein notwendiger Schritt bei der Metallgewinnung, da sich die Metalle nicht direkt aus den Sulfiden gewinnen lassen, wohl aber aus ihren Oxiden.
Röstprozesse
Das Rösten ist ein Aufbereitungsprozess von Erzen, wobei diese in Röstöfen unter Luftzutritt erhitzt werden. Dabei werden die Metallsulfide unedlerer Metalle in ihre Oxide überführt. Da viele Sulfiderze auch Spuren anderer Elemente, z. B. von Arseniden und Antimoniden, Seleniden und Telluriden enthalten, entstehen außer Schwefeldioxid auch flüchtige Sauerstoffverbindungen von Arsen (As), Antimon (Sb), Selen (Se) und Tellur (Te). Diese werden ebenfalls genutzt, um aus ihnen die entsprechenden Elemente herzustellen. Werden Edelmetallerze wie z. B. Silbersulfid geröstet, kann man direkt das reine Metall (in diesem Fall elementares Silber) gewinnen.
Unedle Metalle lassen sich nur in ihre Metalloxide überführen. Durch die Temperatur und Sauerstoffkonzentration kann man regeln, ob das Metallsulfid in Schwefeldioxid und Metalloxid oder in das Metallsulfat überführt wird. Werden im Röstofen die Metallsulfate gewonnen, nennt man dies in der Metallurgie sulfatisierendes Rösten. Metallsulfate haben den Vorteil, dass sie fast alle gut in Wasser löslich sind.
Reaktionsverlauf
Umwandlung des Sulfides eines unedlen Metalles in Schwefeldioxid und Metalloxid:
Umwandlung eines Edelmetallsulfides in Schwefeldioxid und das reine Metall:
Bildung eines Metallsulfats aus dem Metallsulfid:
Das Rösten der sulfidischen Erze ist stark exotherm. Die Entwicklung des sulfidischen Röstens wird MÜLLER VON REICHENSTEIN zugeschrieben.
-
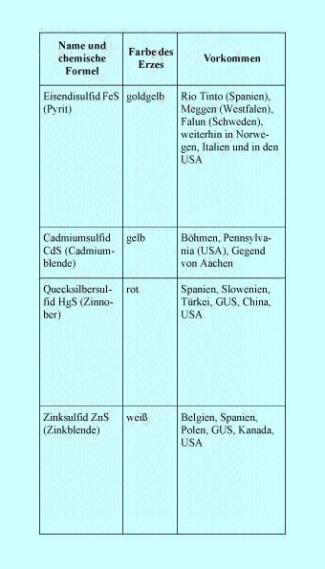
Die Tabelle zeigt typische sulfidische Erze.
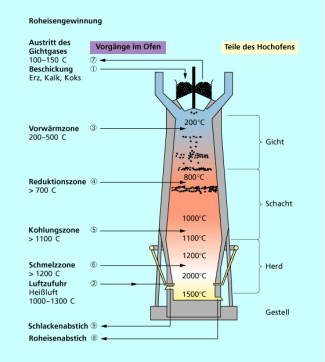
Reduktionsprozesse
Die gewonnenen Metalloxide können auf unterschiedliche Weise reduziert werden. Für die großtechnische Reduktion ist es notwendig, dass das Reduktionsmittel leicht und preiswert erhältlich ist, weshalb am häufigsten Koks (Kohlenstoff) oder das aus Koks gebildete Kohlenstoffmonooxid verwendet werden.
So dient bei der Eisengewinnung im Hochofen das entstandene Kohlenstoffmonooxid als Reduktionsmittel:
2 C + O2 → 2 CO
Manche Metalle, z. B. Wolfram (W) oder Chrom, bilden jedoch mit Kohlenstoff Legierungen, weswegen sie auf andere Weise reduziert werden müssen. Eine Möglichkeit, solche Metalloxide zu reduzieren, ist die Verwendung von Wasserstoff als Reduktionsmittel.
Eine weitere Möglichkeit ist die Anwendung metallothermischer Verfahren, bei denen unedle Metalle als Reduktionsmittel dienen. Zu diesen gehört beispielsweise die Aluminothermie:
Einige Metalle werden auch elektrolytisch aus Lösungen geeigneter Metallsalze gewonnen. So gewinnt man beispielsweise Zink durch katodische Reduktion aus einer Zinksulfat-Lösung.
-
Im Hochofenprozess wird Eisenoxid von Kohlenstoffmonooxid zu Eisen reduziert.