Gittertypen bei Festkörpern
Feststoffe können sehr unterschiedliche Eigenschaften haben, was sich auf die Bindungsverhältnisse zurückführen lässt. Abhängig von der Art der chemischen Bindung im Kristall gibt es unterschiedliche Arten von Strukturen. Bei Metallen kommen beispielsweise andere Strukturtypen vor als bei Ionenverbindungen oder bei Molekülverbindungen. Doch auch innerhalb einer Bindungsklasse, beispielsweise bei den Ionenverbindungen, gibt es verschiedene Gittertypen, d. h. die Ionen sind auf unterschiedliche Weise im Kristall angeordnet.
Stoffe, die fest sind und somit denselben Aggregatzustand haben, können trotzdem sehr unterschiedliche Eigenschaften aufweisen. Manche Feststoffe lassen sich sehr leicht verformen, während andere spröde sind. Manche lassen sich mit dem Finger ritzen, andere nur mit Spezialwerkzeug. Manche lösen sich gut in Wasser, andere praktisch überhaupt nicht. Manche schmelzen beim Erhitzen, andere zersetzen sich.
Doch was ist dafür verantwortlich, dass sich verschiedene Feststoffe so unterschiedlich verhalten?
In allen Festkörpern sind die Teilchen, aus denen sie bestehen, dreidimensional angeordnet. Diese Anordnung kann unregelmäßig sein, dann bezeichnet man den Feststoff als amorph. Ist die Anordnung der Teilchen regelmäßig, d. h. ist ein Feststoff aus sich wiederholenden Struktureinheiten aufgebaut, so nennt man ihn kristallin . Die regelmäßige Struktur in einem Kristall wird als Gitterstruktur oder Kristallstruktur bezeichnet.
Sieht man genauer hin, stellt man allerdings fest, dass es deutliche Unterschiede gibt, was die Wechselwirkungen der Teilchen untereinander betrifft, aus denen ein Kristall aufgebaut ist. Vergleicht man beispielsweise nur die Wasserlöslichkeit und die Schmelzpunkte der drei Feststoffe Magnesium, Zucker und Natriumchlorid (Kochsalz), so gibt es Ähnlichkeiten, aber auch erhebliche Unterschiede. In der Tat spielen die Bindungsverhältnisse, die zwischen den Bausteinen eines Feststoffes herrschen, für seine Eigenschaften eine wichtige Rolle.
So macht es einen erheblichen Unterschied, ob ein Feststoff aus Atomen, Ionen oder Molekülen aufgebaut ist, denn jede dieser Teilchenarten bildet unterschiedliche Bindungen zu seinen Nachbarn aus. Aus der Art der Teilchen und ihrer Wechselwirkung untereinander ergeben sich außerdem unterschiedliche Möglichkeiten ihrer Anordnung. Bestimmte Gitterstrukturen kommen daher nur bei Metallen vor, andere wiederum treten bei ionischen Verbindungen auf.
Je nach Bindungsart lassen sich Metallgitter, Ionengitter, Atom- und Molekülkristalle unterscheiden.
-
Es gibt Feststoffe mit sehr unterschiedlichen Eigenschaften - Zuckerwürfel

Oliver Blondeau - iStock
-
Goldnuggets

kickers - iStock
-
Salzstück

IgorKovalchuk - iStock
Metallgitter
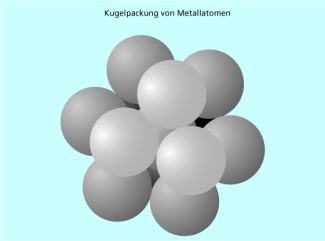
Die Bausteine von metallischen Feststoffen sind Atome. Die Bindung bei Metallen lässt sich durch das sogenannte Elektronengasmodell erklären. Die Metallatome liegen in einem geordneten Gitter vor und geben teilweise ihre Valenzelektronen ab, sodass ein „Elektronengas“ aus frei beweglichen Elektronen entsteht, das durch elektrostatische Anziehung die positiv geladenen Atomrümpfe zusammenhält. Es entstehen Festkörper, in denen die Metallatome regelmäßig in Schichten angeordnet sind. Weil sich die Metallatome untereinander kaum abstoßen und – sofern es sich nicht um eine Legierung handelt – alle gleich groß sind, können sie sehr dicht aneinandergepackt werden. Ein typischer Strukturtyp bei Metallen ist daher die „ dichteste Kugelpackung “, die in zwei Varianten auftritt. Jedes Metallatom in einer dichtesten Kugelpackung ist von zwölf weiteren Metallatomen umgeben, sechs davon in derselben Ebene und jeweils drei in den Ebenen darunter und darüber. Die Koordinationszahl, die die Zahl der direkt benachbarten Teilchen angibt, ist bei diesem Strukturtyp also 12 (Bild 2).
Die Metallatomschichten lassen sich gut gegeneinander verschieben, weil sie immer vom Elektronengas zusammengehalten werden. Aufgrund dessen sind Metalle meist gut verformbar. Bei Legierungen werden Fremdatome ins Metallgitter eingebaut, wodurch die Verschiebbarkeit innerhalb des Gitters eingeschränkt wird. Legierungen, wie z. B. Bronze, sind daher oft härter und spröder als die reinen Metalle, Kupfer und Zinn, aus denen sie bestehen.
-
Um ein Metallatom passen maximal 12 gleiche Metallatome.
Atomgitter
Die kleinsten Bausteine von Atomkristallen sind Atome, die durch kovalente Bindungen (Atombindungen) zusammengehalten werden. Ein Atomkristall kann also sozusagen als ein einziges, riesiges Molekül betrachtet werden.
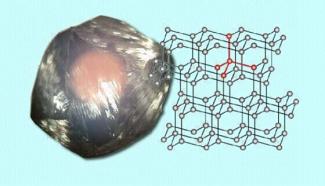
Ein typischer Atomkristall ist Diamant (Bild 3). Er besteht aus Kohlenstoffatomen, die mit jeweils vier weiteren Kohlenstoffatomen tetraedrisch verknüpft sind, die Koordinationszahl ist also 4. Zwischen den Atomen gibt es stabile, gerichtete Bindungen, was dazu führt, dass Diamant einer der härtesten Stoffe überhaupt ist und im Gegensatz zu den Metallen, die aufgrund der vorhandenen freien Elektronen gute elektrische Leiter sind, ein Isolator ist.
-
Diamant ist ein typischer Atomkristall.
Molekülgitter
Molekülkristalle bestehen, wie der Name sagt, aus Molekülen. Auch sie weisen kovalente Bindungen auf, diese verknüpfen die Atome innerhalb der Moleküle miteinander. Die einzelnen Moleküle werden im Kristall jedoch nicht durch kovalente Bindungen, sondern durch van der Waals-Kräfte, in manchen Fällen auch durch Wasserstoffbrückenbindungen zusammengehalten. Die Anziehungskräfte zwischen den Molekülen sind daher normalerweise relativ schwach, weshalb Molekülkristalle wie Zucker oft bei niedrigen Temperaturen schmelzen (Bild 4).
Auch manche Modifikationen bestimmter Elemente lassen sich den Molekülkristallen zurechnen, auch wenn sie strenggenommen keine Molekülverbindungen sind. So besteht beispielsweise Grafit aus Schichten, innerhalb derer die Kohlenstoffatome kovalent gebunden sind. Zwischen den einzelnen Schichten herrschen schwächere van-der-Waals-Kräfte, was dazu führt, dass sie sich leicht gegeneinander verschieben lassen (Bild 5). Grafit ist daher ein weicher Stoff, der z. B. zur Herstellung von Bleistiften und als Schmiermittel verwendet wird.
Ionengitter
Ein Ionengitter besteht aus Ionen, die durch elektrostatische Wechselwirkungen verbunden sind, also wie beim Metallgitter durch ungerichtete Bindungen. Einfluss auf die Gitterstruktur in Ionenkristallen haben sowohl das zahlenmäßige Verhältnis von Anionen und Kationen in einer Ionenverbindung als auch das Verhältnis der Ionenradien.
Das zahlenmäßige Verhältnis von Anionen und Kationen ergibt sich aus den Beträgen ihrer Ionenladungen. Haben diese denselben Betrag wie z. B. bei Natriumchlorid oder Zinksulfid, spricht man von AB-Strukturen, ansonsten unterscheidet man (z. B. Calciumfluorid oder Titandioxid), -Strukturen (z. B. Aluminiumoxid) und andere, noch komplexere Strukturen.
Diese Strukturen treten in unterschiedlichen Varianten auf, die sich in den Koordinationszahlen der Ionen unterscheiden, sie können also weiter unterteilt werden. So unterscheidet man beispielsweise bei den AB-Strukturen die Caesiumfluorid-Struktur (KZ = 8), die Natriumchlorid-Struktur (KZ = 6) und die Zinkblende-Struktur (KZ = 4).
Dass das Radienverhältnis der Anionen und Kationen solchen Einfluss hat, liegt daran, dass es von der Größe der Ionen abhängt, wie viele Anionen um ein Kation passen und umgekehrt. Das Radienverhältnis bestimmt also die Koordinationszahl. Betrachtet wird in der Regel das Verhältnis von Kationenradius zu Anionenradius , also das des kleineren Radius zum größeren, sodass sich Werte <1 ergeben. Ist klein, so bedeutet dies, dass es sich um ein kleines Kation handelt, um das sich nur wenige große Anionen lagern können, da diese sich gegenseitig abstoßen, die Koordinationszahl ist also klein. Je größer das Kation ist bzw. je kleiner die Anionen sind, je größer also ist, desto mehr Anionen passen um ein Kation herum, die Koordinationszahl wird dementsprechend größer.
Anhand des Radienverhältnisses kann man Vorhersagen treffen, welche Kristallstruktur wahrscheinlich vorliegt. Da jedoch auch andere Faktoren die Kristallstruktur beeinflussen, ist der Wert des Radienverhältnisses nicht allein ausschlaggebend.
AB-Strukturen
Caesiumchlorid-Struktur
Bei der Caesiumchlorid-Struktur (CsCl-Struktur) ist die Koordinationszahl 8. Man kann die Struktur als zusammengesetzt aus Würfeln beschreiben, in deren Mittelpunkt sich jeweils ein Anion befindet, während acht Kationen die Ecken des Würfels darstellen und umgekehrt.
![]()
-
Zucker ist ein Molekülkristall.

Heinz Mahler - H. Mahler, Fotograf, Berlin
-
Grafit ist eine Modifikation des Kohlenstoffs.

cevahir87 - adobe stock
Natriumchlorid-Struktur
Die Koordinationszahl für die Ionen bei der Natriumchlorid-Struktur (NaCl-Struktur) ist 6. Die Struktur eines solchen Kristalls kann man als aus vielen Würfeln zusammengesetzt beschreiben, wobei die Ionen immer abwechselnd an den Würfelecken sitzen. Jedes Ion ist also oktaedrisch von sechs Ionen mit entgegengesetzter Ladung umgeben (Bild 6).
![]()
Zinkblende-Struktur
Bei der Zinkblende-Struktur (ZnS-Struktur) besitzen die Ionen die Koordinationszahl 4, d. h. jedes Anion ist tetraedrisch von vier Kationen umgeben und umgekehrt (Bild 7).
![]()
Bei den kommen auf ein Kation zwei Anionen. Da doppelt so viele Anionen wie Kationen im Kristall vorhanden sind, ist die Koordinationszahl der Kationen doppelt so groß wie die der Anionen.
Auch hier gibt es drei wesentliche Strukturtypen:
Fluorit-Struktur
Bei der Fluorit-Struktur haben die Kationen die Koordinationszahl 8 und die Anionen die Koordinationszahl 4. Die Kationen sind also wie bei der Caesiumchlorid-Struktur würfelförmig von acht Anionen umgeben, die Anionen hingegen tetraedrisch von vier Kationen.
Rutil-Struktur
Das Koordinationszahlenverhältnis bei der Rutil-Struktur ist 6:3, d. h. die Kationen sind von sechs Anionen oktaedrisch umgeben, die Anionen von drei Kationen.
Cristobalit-Struktur
Die Cristobalit-Struktur ist nach einer Modifikation des Siliciumdioxids benannt. Hier haben die Ionen die Koordinationszahl 4 bzw. 2, d. h. die Kationen sind tetraedrisch von vier Anionen koordiniert, die Anionen linear von zwei Kationen.

