Polyvinylchlorid (PVC)
PVC ist die allgemeingültige Abkürzung für den Kunststoff Polyvinylchlorid. Die Herstellung erfolgt durch die radikalische Polymerisation von Vinylchlorid (Monochlorethen).
Es wird zwischen Hart- und Weich-PVC unterschieden. Letzteres enthält Weichmacher, die die zwischenmolekularen Kräfte zwischen den Polymerketten herabsetzen, sodass der Kunststoff weich und biegsam wird. Weich-PVC wird z. B. in Kunstleder oder als Fußbodenbelag verwendet, Hart-PVC hingegen zur Herstellung von Dachrinnen und Bauteilen. Wegen seiner umweltgefährdenden Eigenschaften durch das enthaltene Chlor ist es zunehmend in die öffentliche Diskussion geraten.
PVC-Herstellung
1. Herstellung des Vinylchlorids
Ausgangsstoff für die Polymerisation zum Polyvinylchlorid (PVC) ist Vinylchlorid (Monochlorethen).
Um es herzustellen, gibt es zwei Möglichkeiten, wobei als Ausgangsstoff einmal Ethin und einmal Ethen dient.
Die erste Möglichkeit ist die Reaktion von Chlorwasserstoff (HCl) mit Ethin (Acetylen). Bei einer Temperatur von 200 °C und unter Druck wird Chlorwasserstoff an die Dreifachbindung des Ethins addiert und bildet Vinylchlorid.
Die Reaktion geschieht in Gegenwart von Quecksilber(II)chlorid als Katalysator.
Dieses Verfahren ist das ältere, es wurde um 1912/1913 von den Chemikern F. KLATTE und E. ZACHARIAS entwickelt. Da jedoch die Herstellung von Ethin teurer ist als die von Ethen, das in großen Mengen durch die Pyrolyse von Erdölfraktionen gewonnen werden kann, wird vorwiegend die folgende Variante durchgeführt:
Bei dieser zweiten Möglichkeit verwendet man Ethen als Ausgangsstoff. In einem ersten Schritt wird Chlor an Ethen addiert.
Aus dem dabei entstandenen 1,2-Dichlorethan wird dann am Katalysator bei 300 - 350 °C Chlorwasserstoff abgespalten und es entsteht Vinylchlorid.
-
Viele Badutensilien werden aus PVC hergestellt.

2. Polymerisation des Vinylchlorides zu PVC
Die Polymerisation des Vinylchlorides erfolgt nach einem radikalischen Mechanismus (Bild 2).
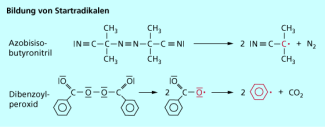
Bei der radikalischen Polymerisation geschieht die Aktivierung durch Radikalstarter, auch Initiatoren genannt. Dies sind Moleküle, die bereits bei vergleichsweise geringer Energiezufuhr in Radikale zerfallen und eine Kettenreaktion in Gang setzen. Als Initiatoren dienen bei der Herstellung von PVC z. B. Peroxide wie Dibenzoylperoxid (Bild 3). In der industriellen Produktion werden heute andere Peroxide, die bereits bei niedrigen Temperaturen wirksam sind, als Initiatoren eingesetzt, da diese preisgünstiger sind.
3. Weiterverarbeitung des PVC
Das entstandene PVC-Pulver beginnt bei ca. 80 °C zu erweichen.
Bei stärkerer Erwärmung von PVC wird Chlorwasserstoff freigesetzt, der den weiteren Zerfall des PVC katalysiert und somit beschleunigt.
Um dies zu verhindern, werden Stabilisatoren zugesetzt, die z. T. giftige Schwermetallverbindungen enthalten.
Eigenschaften des PVC
Polyvinylchlorid zählt zu den Thermoplasten, es wird also beim Erhitzen weich und plastisch verformbar.
Polyvinylchlorid ist geruchs- und geschmacksfrei, beständig gegen Wasser, gegen viele organische Lösungsmittel und gegen schwache Säuren und Basen. Polyvinylchlorid besitzt eine schlechte Wärmeleitfähigkeit und eine schlechte elektrische Leitfähigkeit. Bei Wärmeeinwirkung zersetzt es sich langsam. Seine Dichte beträgt 1,38 und die Druckfestigkeit 55 - 90 MPa. Es ist schwer entflammbar.
Geschichte und Verwendung des PVC
PVC wird seit dem Jahre 1913 technisch hergestellt.
Das Monomer Vinylchlorid war schon seit 1838 bekannt, aber erst 1912 gelang dem deutschen Chemiker FRITZ KLATTE die Polymerisation, bei der er Peroxide als Initiatoren einsetzte. Die großtechnische Anwendung dieses Verfahrens erfolgte allerdings erst kurz vor dem 2. Weltkrieg.
Noch später, erst in den späten 50er Jahren, wurde PVC zu einem der wichtigsten Kunststoffe des täglichen Gebrauchs.
-
Ablauf der radikalischen Polymerisation
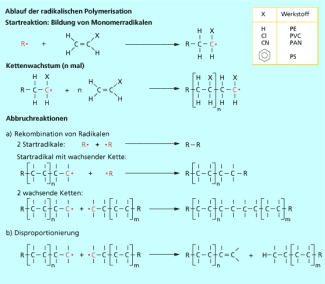
-
Initiatoren für die radikalische Polymerisation
Die Verwendungsmöglichkeiten von PVC sind sehr vielseitig. Das so genannte Hart-PVC, das ungefähr zwei Drittel des produzierten PVC darstellt, wird für Haushaltsgegenstände, Verpackungsmaterial, Platten, Rohre, Ventile und Hähne verwendet.
Setzt man dem PVC Weichmacher in Mengen von 15-30 % zu, erhält man Weich-PVC, welches wesentlich elastischer ist.
Als Weichmacher werden z. B. Phthalsäureester oder Adipinsäureester verwendet.![]() Wegen seiner Elastizität kann Weich-PVC zur Herstellung von Schläuchen und Fußbodenbelägen oder Kunstleder verwendet werden.
Wegen seiner Elastizität kann Weich-PVC zur Herstellung von Schläuchen und Fußbodenbelägen oder Kunstleder verwendet werden.
Probleme mit PVC
Die Vielfalt der PVC-Produkte führte in den 60er Jahren des 20. Jahrhunderts zu einer starken Verbreitung dieses Kunststoffes.
In dieser Zeit kamen aber auch die ersten Vorbehalte gegen PVC in die Öffentlichkeit.
Die Arbeiter, die bei der PVC-Produktion mit dem giftigen Vinylchlorid zu tun hatten, zeigten krankhafte Veränderungen an Haut, Lunge und Gelenken. Die VC-Krankheit (Vinylchlorid-Krankheit) wurde von der Berufsgenossenschaft als Berufskrankheit anerkannt.
Eine Schwierigkeit bei der Entsorgung von Polyvinylchloriden liegt in der Entstehung von Chlorwasserstoffdämpfen und giftigen Dioxinen bei der Verbrennung. Dies erfordert den Einbau teurer Vorrichtungen zur Abgasreinigung in Verbrennungsanlagen für industrielle Abfälle und für Hausmüll.
Ein weiteres Problem ist die mögliche Freisetzung von Weichmachern, die potenziell gesundheitsschädlich sind. So wurde z. B. die Verwendung von PVC für Babyspielzeug in Deutschland verboten, da sich die Weichmacher beim Lutschen am Spielzeug herauslösen können.
Auf Mülldeponien besteht die Gefahr, dass die Schwermetalle, die als Stabilisatoren verwendet werden, und die Weichmacher aus dem PVC in das Grundwasser gelangen können.
-
Gegenstände aus Hart-PVC

Heinz Mahler, Berlin
-
Häufig verwendete Weichmacher in PVC


