Stärke von Säuren und Basen
Die Stärke von BRÖNSTED-Säuren und -Basen ergibt sich ausschließlich aus der Lage des Protolysegleichgewichts. Je größer die Gleichgewichtskonstante , desto stärker ist die Säure, je höher der Wert von , um so stärker ist die entsprechende Base. In Abhängigkeit von ihren - und Werten unterscheidet man zwischen sehr starken, starken, schwachen und sehr schwachen Säuren bzw. Basen.
Die Stärke von Säuren und Basen ist nicht gleichzusetzen mit ihrer aggressiven Wirkung. So ist z. B. die Flusssäure (HF), eine der reaktivsten Säuren, die sogar Glas angreift, nur eine relativ schwache Säure. Für die Säurestärke wird auch häufig der synonyme Begrif Acidität und für die Basenstärke der Begriff Basizität verwendet.
Die Stärke von BRÖNSTED-Säuren und -Basen
Die Stärke von BRÖNSTED-Säuren und -Basen ergibt sich ausschließlich aus der Lage des Protolysegleichgewichts. Je größer die Gleichgewichtskonstante , desto stärker ist die Säure, je höher der Wert von , um so stärker ist die entsprechende Base. In Abhängigkeit von ihren - und Werten unterscheidet man zwischen sehr starken, starken, schwachen und sehr schwachen Säuren bzw. Basen.
Die Stärke von Säuren und die Stärke von Basen ist nicht gleichzusetzen mit ihrer aggressiven Wirkung. So ist Flusssäure, HF, zwar nur eine schwache, aber dennoch eine der reaktivsten Säuren. Sie zersetzt die meisten Metalle, Mineralien und Kunststoffe und löst sogar Glas auf.
Die Protolyse einer Säure, HA, in Wasser lässt sich nach dem Massenwirkungsgesetz folgendermaßen beschreiben:
Wie beim Autoprotolysegleichgewicht des Wassers wird auch hier die -Konzentration als konstante Größe in den K-Wert einbezogen.
Das Produkt wird als Säurekonstante bezeichnet. Auf die gleiche Weise ist die Basenkonstante einer Base B definiert:
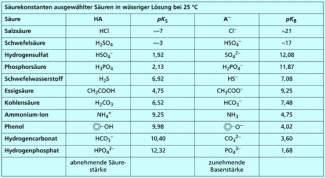
Je vollständiger die Protonenübertragung erfolgt, desto stärker liegt das Protolysegleichgewicht auf der rechten Seite und umso stärker ist die jeweilige Säure bzw. Base. Das heißt, je größer der -Wert einer Säure ist, desto stärker ist die Säure. Analog ist eine Base umso stärker, je größer ihr -Wertes ist.
Anstelle des - oder -Wertes wird häufig der - bzw. -Wert angegeben, der wiederum dem negativen dekadischen Logarithmus des jeweiligen K-Wertes entspricht. Definitionsgemäß zeigen hier kleine Werte für bzw. starke Säuren bzw. starke Basen an, während umgekehrt große Werte für bzw. schwache Säuren bzw. Basen kennzeichnen.
Essigsäure ist eine schwache Säure, Ammoniak eine schwache Base, sodass beide in wässriger Lösung nur teilweise protolysieren und die protonierten und deprotonierten korrespondierenden Partner in einem realen Gleichgewicht vorliegen.
Sehr starke Säuren protolysieren in Wasser dagegen vollständig, das heißt die Konzentration der entspricht exakt der Konzentration der Säure. Da in solchen Fällen alle Protonen von der Säure auf Wasser übertragen werden, lässt sich die Stärke der Säuren nicht mehr unterscheiden, sie scheinen alle gleich stark zu sein. In wässriger Lösung ist demnach das Oxonium-Ion die stärkste mögliche Säure.
Umgekehrt gilt für Basen, dass keine Base in Wasser stärker sein kann als das Hydroxid-Ion, da sie vollständig Protonen vom Wasser unter Bildung von aufnehmen.
Diese Wirkung des Lösungsmittels Wasser auf sehr starke Säuren und Basen nennt man den nivellierenden Effekt des Wassers.
Die Reaktionen einer Säure und ihrer korrespondierenden Base mit Wasser können auch getrennt als Gleichgewichtsreaktionen betrachtet werden:
Aus der Multiplikation der beiden Gleichgewichtskonstanten ergibt sich durch Kürzen das Ionenprodukt des Wassers. Daraus folgt, dass in korrespondierenden Säure-Base-Paaren die jeweiligen - und -Werte miteinander gekoppelt sind, sodass bei Kenntnis eines dieser Werte sich der andere leicht errechnen lässt.
daraus folgt:
Zu jedem korrespondieren Säure-Base-Paar existieren ein - und ein -Wert. Je stärker eine Säure, desto schwächer ist ihre konjugierte Base. Umgekehrt gilt das Gleiche für eine Base (Bild 2).
Säurestärke und Molekülstruktur
Die Stärke von BRÖNSTED-Säuren ändert sich entsprechend atomarer Eigenschaften, die aus der Stellung der Elemente im PSE abgeleitet werden können. Dabei unterscheidet man zwischen Säuren, in denen Wasserstoffatome nicht an Sauerstoffatome gebunden sind und Oxosäuren.
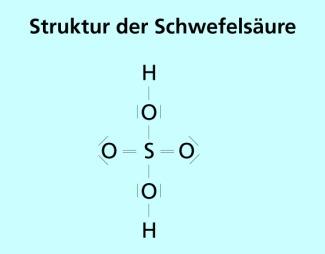
In Oxosäuren, wie der Schwefelsäure, sind die Wasserstoffatome an Sauerstoffatome gebunden (Bild 3).
Element-Wasserstoff-Verbindungen
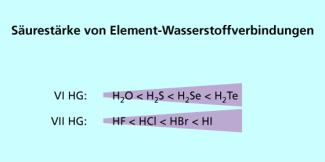
Die Säurestärke von Säuren, in denen die Protonen nicht an Sauerstoffatome gebunden sind, z. B. oder HCl, wird von zwei Faktoren beeinflusst: der Elektronegativität und der Atomgröße des Elements, das die Protonen bindet. Diese beiden Einflussgrößen zeigen sich sehr deutlich beim Vergleich der Säurestärke von Element-Wasserstoff-Säuren innerhalb einer Periode (starke Änderung der Elektronegativität) sowie innerhalb einer Hauptgruppe (starke Änderung der Atomgröße).
Die Änderung der Atomgröße innerhalb einer Periode ist unbedeutend im Vergleich zum Einfluss der EN. Die Abnahme der EN ist innerhalb einer Gruppe gegenüber der Änderung der Atomgröße vernachlässigbar.
Die Säurestärke von Element-Wasserstoff-Verbindungen einer Periode im PSE nimmt von links nach rechts mit steigender Elektronegativität der Elemente zu.
Die Ursache für die Zunahme der Säurestärke vom Ammoniak zur Flusssäure ist, dass mit steigender Elektronegativität des Elements E die gemeinsamen Bindungselektronen der E-H-Bindung stärker zu E gezogen werden. Die daraus resultierende Polarisierung der Atombindung ermöglicht eine leichtere Spaltung der E-H-Bindung durch das polare Lösungsmittel Wasser.
Innerhalb einer Gruppe des PSE nimmt die Säurestärke der Wasserstoff-Element-Verbindungen mit steigender Atomgröße und somit steigender Ordnungszahl zu (Bild 4).
Durch die Zunahme der Atomgröße des Elements, an das die Wasserstoffatome gebunden sind, wird die Überlappung der Atomorbitale geringer. Dadurch wird die E-H-Bindung schwächer und kann einfacher heterolytisch gespalten werden. Folglich kann das Proton leichter abgegeben werden, sodass die Säurestärke der Verbindungen zunimmt.
Oxosäuren
Allen Oxosäuren gemeinsam ist die allgemeine Baugruppe:
![]()
In Oxosäuren sind die Wasserstoffatome direkt an Sauerstoffatome gebunden, deren Größe nahezu konstant ist. Deshalb wird die Säurestärke von Oxosäuren im Wesentlichen von der Elektronegativität des Elements E bestimmt, an das die Sauerstoffatome gebunden sind. Wenn E beispielsweise ein Metall mit geringer Elektronegativität ist, wird das zwischen E und O befindliche Elektronenpaar zum Sauerstoff gehören. Die E-O-Bindung ist stark polar, und somit wird das polare Lösungsmittel Wasser diese Bindung und nicht die wenig polare O-H-Bindung spalten. Die Verbindung reagiert als typische BRÖNSTED-Base, wie NaOH oder Die Bindung zwischen Na und O ist polarer als die zwischen O und H. Die Bindung zwischen O und H ist polarer als die zwischen Cl und O.
Wenn aber E ein stark elektronegatives Nichtmetallatom ist, dann wird die Elektronendichte der E- O-Bindung zwischen E und O verteilt sein, selbst wenn Sauerstoff elektronegativer ist. Das hat aber zur Folge, dass nunmehr die O - H-Bindung wesentlich polarer und damit leichter durch Wasser spaltbar wird. Die Nichtmetallverbindung zeigt somit das typische Verhalten einer BRÖNSTED-Säure.
Je elektronegativer das Elementatom E ist, desto stärker werden der O - H-Bindung Elektronen entzogen und desto leichter lässt sich das Proton abspalten. Mit steigender Elektronegativität des zentralen Atoms E nimmt somit die Säurestärke zu.
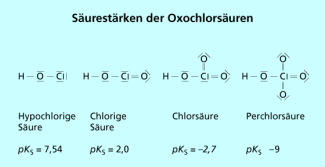
In der Reihe der Oxohalogensäuren steigt z. B. die Säurestärke der hypohalogenigen Säuren HOX mit zunehmender Elektronegativität des Halogenatoms X in folgender Reihenfolge:
HOI < HOBr < HOCl
In vielen Oxosäuren sind weitere Sauerstoffatome am zentralen Atom E gebunden. Die zusätzlichen Sauerstoffatome entziehen dem Element weitere Elektronendichte und machen es so stärker elektronegativ. Als Konsequenz daraus wird weitere Elektronendichte vom Sauerstoff der OH-Gruppe entzogen, was wiederum zur Elektronendichteverringerung der O-H-Bindung führt. Die damit einhergehende Schwächung der O-H-Bindung und daraus resultierende leichtere Spaltbarkeit hat eine Erhöhung der Acidität zur Folge. So verändert sich z. B. die Säurestärke der Oxochlorsäuren (Bild 5).
Da die Einführung zusätzlicher Sauerstoffatome einer Erhöhung der Oxidationszahl des zentralen Atoms E entspricht, folgt daraus, dass mit steigender Oxidationszahl des Atoms E einer Oxosäure deren Säurestärke zunimmt.
So steigt in der Reihe der Oxochlorsäuren die Oxidationszahl des Chlors von I bei der hypochlorigen Säure (HOCl) bis VII für Perchlorsäure
Suche nach passenden Schlagwörtern
- starke Basen
- starke Säuren
- Oxohalogensäuren
- Protolyse
- schwache Säuren
- Elektronegativität
- Element-Wasserstoff-Verbindungen
- Atomgröße
- Stärke von Basen
- Säurestärke
- nivellierenden Effekt des Wassers
- Basekonstante
- schwache Basen
- Rechenbeispiel
- Acidität
- Stärke von Säuren
- BRÖNSTED-Basen
- BRÖNSTED-Säuren
- Säurekonstante
- Oxosäuren
- Gleichgewichtsreaktionen