Anorganische Säuren
Säuren sind chemische Verbindungen, die in wässriger Lösung Protonen (Wasserstoff-Ionen) abgeben können. Sie haben eine ätzende Wirkung und bilden in Verbindung mit Basen entsprechende Salze. Säuren färben den Indikator Lackmus rot.
Sowohl in der chemischen Industrie als auch im täglichen Leben haben Säuren eine immense Bedeutung. Sie sind Bestandteil vieler Reinigungsmittel und sind als Ausgangsstoffe chemischer Synthesen, z. B. die Produktion von Düngemitteln, Baustoffen, Metallen und Kunststoffen unverzichtbar. Die Salzsäure ist als Bestandteil der Magensäure an der Verdauung beteiligt.
Weitere vielfältig verwendete anorganische Säuren sind die Schwefelsäure, die Phosphorsäure oder die Salpetersäure.
Die Definition nach BRÖNSTED betrachtet Säuren als Verbindungen, die Protonen an andere Verbindungen abgeben können. Solch ein Stoff wird dann als Protonendonator (lat. donare = spenden) bezeichnet. In wässriger Lösung werden die Protonen auf Wasser als Base (Protonenakzeptor) übertragen. Bei der Protolyse bilden sich die sogenannten Hydronium-Ionen :
Diese Hydronium- oder auch Oxonium-Ionen sind der wirksame Bestandteil von Säuren. Die verbleibenden, teilweise sehr unterschiedlichen Säurereste bestimmen die Säurestärke und die chemischen Eigenschaften der Säure.
Hydroxid-Ionen der Laugen reagieren mit den Oxonium-Ionen der Säuren unter Wasserbildung. Diese exotherme Reaktion nennt man Neutralisation:
Hierbei bildet sich neben Wasser ein aus einem Kation und aus einem Anion zusammengesetzter Stoff, ein Salz.
Säurebildung
Säuren bilden sich durch Reaktionen zwischen Nichtmetalloxiden und Wasser.
In diesem Zusammenhang sei daran erinnert, dass Kohlenstoffdioxid oft fälschlicherweise als Kohlensäure bezeichnet wird. Es ist aber das Säureanhydrid, das zudem im Wasser zum größten Teil physikalisch gelöst vorliegt und in geringem Umfang zur Kohlensäure reagiert.
H2O + CO2 H2CO3
Nicht alle Säuren entstehen durch die Reaktion des entsprechenden Säureanhydrids mit Wasser. Die Chlorwasserstoffsäure HCl hat kein Säureanhydrid, ist aber im BRÖNSTED-Sinn eine Säure, weil sie bei der Reaktion mit Wasser ein Proton abspaltet.
-
Kohlensäure im Mineralwasser

Wichtige anorganische Säuren
Die wichtigsten anorganischen Säuren sind Salzsäure, Schwefelsäure, Salpetersäure und Phosphorsäure. Mit Ausnahme der mittelstarken Phosphorsäure sind es starke Säuren, die in Wasser vollständig dissoziiert sind.
Salzsäure HCl ist die wässrige Lösung von Chlorwasserstoff. Das Molekül reagiert mit Wasser zu Oxonium-Ionen und Chlorid-Ionen.
Salzsäure ist eine farblose bis gelbliche, stechend riechende Flüssigkeit, sie wirkt ätzend und greift unedle Metalle an.
Salzsäure wird zur Metallreinigung, zur Herstellung von Chloriden und organischen Chlorverbindungen sowie zur Neutralisation von Abwässern eingesetzt. Salzsäure wird im Magen als Magensäure gebildet und schafft das saure Milieu für die Wirkungsmöglichkeit des Stoffwechselenzyms.
Schwefelsäure kann zwei Protonen abgeben und dissoziiert in Wasser unter Bildung von Sulfationen.
Schwefelsäure ist eine stark hygroskopische ölige Flüssigkeit. Sie wirkt stark ätzend und zerstört organische Materialien. Das Verdünnen von konzentrierter Schwefelsäure mit wasser verläuft unter starker Wärmeentwicklung (Vorsicht!).
Schwefelsäure wird vielfältig verwendet, beispielsweise zur Herstellung von Phosphorsäure und Phosphatdüngemitteln, zur Gewinnung des weißen Farbpigments Titandioxid aus Titanerzen, zur Herstellung von Waschmitteln und Farbstoffen. In den Bleiakkumulatoren ist Schwefelsäure als Batteriesäure enthalten.
Phosphorsäure reagiert mit Wasser zu Oxonium-Ionen und Phosphat-Ionen. Dabei wird das letzte Proton nur bei der Neutralisation der Säure mit Basen vollständig abgegeben.
Phosphorsäure ist in reiner Form ein weißer Feststoff, der sich in Wasser gut löst.
Sie wird zur Herstellung von Phosphaten und Phosphatdüngemitteln, zur Herstellung von Weichmachern und Oberflächenschutzmitteln für Eisen und als Lebensmittelzusatzstoff eingesetzt. Fast alle Cola-Getränke enthalten Phosphorsäure als Säuerungsmittel. Auch in unserem Körper spielt Phosphorsäure eine wichtige Rolle, der Zahnschmelz besteht aus Calciumphosphat und die Grundbausteine der DNA enthalten stickstoffhaltige Basen, Zucker und Phosphorsäurereste.
Wasch- und Reinigungsmittel für Haushalt und Gewerbe enthalten z. T. heute noch Phosphate, die Salze der Phosphorsäure. Polyphosphate (hauptsächlich Pentanatriumtriphosphat) können in Wasch- und Reinigungsmitteln mehrere Funktionen übernehmen. Sie machen das Wasser weicher und gewährleisten den optimalen pH-Wert für den Wasch- bzw. Reinigungsvorgang. Des weiteren werden Schmutzpartikel vom Gegenstand abgehoben, wodurch zum Beispiel die Rückvergrauung der Textilien in der Waschlauge verhindert werden kann. Typische Rezepturen von kompakten und tablettenförmigen Maschinengeschirrspülmittel enthielten 30 bis 60 % Phosphate. Diese sind aber heute weitgehend durch umweltfreundlichere Wasserenthärter ersetzt worden.
Salpetersäure dissoziiert in Wasser in Oxonium-Ionen und Nitrat-Ionen.
Die handelsübliche konzentrierte Salpetersäure mit einem Gehalt von 65-70 % HNO3 ist eine farblose bis gelbliche Flüssigkeit. Sie riecht stechend und wirkt stark oxidierend und ätzend.Sie löst in konzentrierter Form die meisten unedlen Metalle und Silber, nicht aber Gold und Platin. Sie wird zur Herstellung von Nitratdüngemitteln, als Nitrier- und Oxidiermittel und als „Scheidewasser“ zur Trennung von Gold und Silber eingesetzt.
Zur Herstellung von Sprengstoffen benötigt man hochkonzentrierte Salpetersäure mit einer Konzentration von über 95 %.
Ökologie
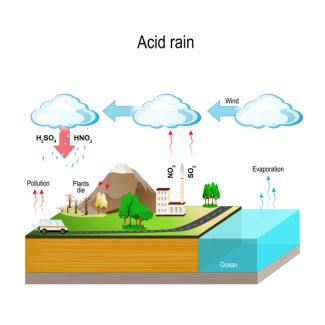
Das Schwefeldioxid und die Stickstoffoxide, die bei der Verbrennung der Brennstoffe entstehen, gelangen in höhere Luftschichten und damit in Wolken, in denen sich Regenwasser sammelt. Das Schwefeldioxid löst sich im Regenwasser der Wolken und bildet schweflige Säure () und Schwefelsäure. Die Stickoxide bilden salpetrige und Salpetersäure. Das Wasser in der Wolke wird dadurch sauer und regnet als Saurer Regen auf den Boden nieder. Der pH-Wert im Boden und in den Gewässern sinkt dadurch. Die Bäume nehmen die Schadstoffe über die Wurzeln aus dem Grundwasser, direkt über die Luft oder über den sauren Regen auf.
-
Entstehung und Auswirkung des sauren Regens.
ttsz - iStock

