Ethanol
„Alkohol“ – die Volksdroge Nummer 1, ist chemisch betrachtet „Ethanol“, also ein einfacher aliphatischer gesättigter Alkohol.
Seine Eigenschaften ähneln stark dem des Methanols. Typische Reaktionen sind die Veresterung mit Carbonsäuren und die Oxidation zu Acetaldehyd (Ethanal), Essigsäure und Kohlenstoffdioxid. Obwohl er für Lebewesen in höheren Dosen äußerst giftig ist, kommt er in der Natur relativ häufig vor. Bei Gärprozessen, z. B. bei Fallobst, zersetzen Hefepilze zucker- oder stärkehaltige Substanzen zu Ethanol.
Die Wirkungen auf den Menschen sind bei geringen Dosen nicht gefährlich, zumindest bei Erwachsenen und Nichtschwangeren. Zu chronischen Alkoholvergiftungen und damit schweren Organschäden kommt es, wenn der tägliche Alkoholkonsum zu groß wird.
Ethanol dient in der Industrie vor allem als Lösungsmittel, Brennstoff und Ausgangsstoff zur Herstellung weiterer Chemikalien. Zunehmend wird er auch als Treibstoff verwendet.
Ethanol () ist oftmals auch unter den Namen Äthanol, Ethylalkohol, „Alkohol“ oder Weingeist bekannt. In der homologen Reihe der Alkohole steht er an zweiter Stelle, hinter dem Methanol.
Eigenschaften:
Ethanol ist eine farblose, klare, brennbare, leicht entzündliche, alkoholisch riechende Flüssigkeit mit einem brennenden Geschmack. Er verbrennt mit blassblauer, schwach leuchtender Flamme zu Kohlenstoffdioxid und Wasserdampf.
Stoffdaten:
| Schmelzpunkt (°C) | Siedepunkt (°C) | Dichte, 25 °C (g/cm3) | Mischbarkeit |
| -114,5 | 78,3 | 0,789 | vollständig mit: Wasser, Methanol, Ether, Benzen, Benzin |
Bei der Reaktion mit Alkalimetallen entsteht Wasserstoff und das entsprechende Alkoholat (Salz). Ethanol zeigt die für primäre Alkohole typischen Reaktionen, z. B. Oxidation (durch starke Oxidationsmittel wie Kaliumpermanganat, Chromsäure) zu Acetaldehyd und Essigsäure. In der freien Natur kommt Ethanol relativ häufig, wenn auch in geringen Mengen vor. Die allgegenwärtigen Hefepilze vergären nasse stärke- und zuckerhaltige Substanzen zu Ethanol (Gärung), so z. B. in Fallobst oder Brotteig.
-
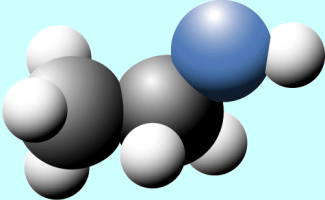
Modell des Ethanolmoleküls (grau: Kohlenstoff, blau: Sauerstoff, weiß: Wasserstoff)
Physiologische Wirkungen:
Reiner Alkohol (Ethanol) (96 %ig) ist für alle Organismen stark giftig. Bakterien werden im allgemeinen in 70 %igem Alkohol abgetötet, da bei dieser Konzentration ihre Plasmaeiweiße denaturieren.
Auf den Menschen wirkt Alkohol in geringen Mengen anregend, in größeren Mengen oder in hohen Konzentrationen jedoch giftig. Die Aufnahme erfolgt über den Verdauungstrakt, die Mundschleimhaut und durch Resorption über die Haut. In der Leber wird fast der gesamte Alkohol über die Zwischenprodukte Acetaldehyd (Ethanal) und Essigsäure zu Kohlenstoffdioxid und Wasser oxidiert.
Nur eine kleine Menge wird über den Harn und die Atemwege ausgeschieden. Die Wirkung von Ethanol auf den Organismus hängt von vielen Faktoren, wie z. B. Alter und Geschlecht ab. Die Letaldosis (bei der in der Regel der Tod eintritt) ist bei Kindern sehr gering (ca. 30 g, das entspricht etwa dem Alkoholgehalt von einem Liter Bier). Bei Männern treten ernsthafte Organschäden bei einem Konsum von 50 ml pro Tag, bei Frauen schon bei 20 ml pro Tag auf. Besonders gefährlich ist der Alkoholkonsum von Schwangeren, da der Alkohol sehr leicht in den Blutkreislauf des Embryos übergeht. Das ungeborene Kind kann davon schwer geschädigt werden.
Erste Symptome einer Alkoholvergiftung sind zunächst die Lähmung von Hemmungszentren im Zentralnervensystem, Reflexsteigerung, körperliche Erregung und gesteigerter Bewegungsdrang. Der aufgenommene Alkohol ist nach etwa 1 Stunde auf die gesamte Körperflüssigkeit (einschließlich Blut), die etwa 70 % der Körpermasse ausmacht, verteilt. Bereits ab einem Blutalkoholgehalt von 0,5 ‰ treten erste motorische Störungen auf.
Wenn ein Mann von 75 kg Körpergewicht 3 Gläser Wein von 100 ml mit 12,5 Vol.-% (das sind 10 Masse-%) trinkt, sind das 30 g Ethanol. Der Blutalkoholgehalt wäre dann nach der Rechnung
30 g/52,5 kg Körperflüssigkeit = 0,57 ‰,
in dieser Größenordnung.
Bei weiterem Alkholkonsum kommt es zu Lähmungen von motorischen Zentren, Muskelerschlaffung, Ermüdung, Bewegungsunsicherheiten (Gehen, Stehen), Erschwerung der Sprache. Hinweise auf die Beeinträchtigung der Fährtüchtigkeit durch Alkoholkonsum sind wohl nicht nötig. Da Alkohol die Blutgefäße weitet, kommt es leicht zu gefährlichen Unterkühlungen. Kopfschmerzen, Erbrechen. Erinnerungslücken, die ab etwa 2 ‰ auftreten, und Übelkeit sind die Nachwirkungen einer Alkoholvergiftung. Anzeichen einer chronischen Alkoholvergiftung, welche durchaus zu den Suchtkrankheiten zu zählen ist, sind im allgemeinen leichte bis schwere Organschäden, wie z. B. Verdauungsstörungen, Magen-Darm-Reizungen, Herzmuskelerkrankungen, Schädigung des Zentralnervensystems und vor allem Leberschäden, wie z. B. Leberverfettung und Leberzirrhose. Der akute Alkoholtod tritt durch Lähmung des Atemzentrums ein. Die letale Dosis beträgt ca. 5 Promille Alkohol im Blut. Das entspricht ca. 200-250 g reinem Alkohol.
Die Abbaugeschwindigkeit ist unterschiedlich, sie beträgt bei Männern etwa 0,15 ‰ pro Stunde und bei Frauen etwa 0,1 ‰ stündlich. Nach Genuss der obigen drei Gläser Wein müsste ein Mann demnach mindestens 4 Stunden, eine Frau aber 6 Stunden warten, bis der Alkoholspiegel im Blut wieder auf den Wert 0 ‰ zurückgegangen ist.
Herstellung:
Man kann Ethanol enzymatisch mittels Hefepilzen durch Vergären von Glucose erhalten, wie es beispielsweise bei der Herstellung von Wein üblich ist.
C6H12O6 → 2 C2H5OH + 2 CO2
Allerdings kann man auf diese Weise nur einen Ethanolgehalt der Lösung von maximal ca. 15 % erhalten, da bei höheren Konzentrationen die Enzyme unwirksam werden. Es ist aber möglich, durch eine ständige Abtrennung des Ethanols aus der Lösung – beispielsweise über eine Membran oder durch Extraktion – die Enzyme praktisch in „Dauerproduktion“ zu halten. Die andere Möglichkeit besteht darin, den Ethanolgehalt durch Destillation („Brennen“) zu erhöhen. Da Ethanol mit Wasser ein Azeotrop bildet, kann man üblicherweise nur eine Höchstkonzentration von 96 % Ethanol erreichen. Die Gewinnung von „absolutem“ (100 %) Ethanol erfordert spezielle Techniken.
Da die Menge an Gärungsalkohol den Bedarf insbesondere für technische Zwecke nicht decken kann, wird Ethanol auch technisch durch katalytische Addition von Wasser an Ethen hergestellt. Man arbeitet bei 250-300 °C und einem Druck von 6-8 MPa z. B. mit Phosphorsäure auf Siliciumdioxid als Katalysator unter Wasserüberschuss:
CH2=CH2 + H2O → CH3–CH2OH Q = -46 kJ/mol
Ethanol wird dann aus dem Gemisch abdestilliert.
Verwendung:
Ein Teil des Ethanols wird in Form von alkoholischen Genussmitteln verbraucht. Weiterhin dient er als wertvolles Lösungsmittel für Öle, Fette, Harze und viele Farbstoffe aber auch für Duftstoffe, so z. B. in Kosmetika, wie Rasierwasser und anderen Riechstoffen. Konzentrierter (96 %iger) Alkohol wird wegen seines hohen Brennwerts als „Brennspiritus“ verwendet (rein oder im Gemisch mit Benzin). Als Motortreibstoff kann Ethanol sowohl im Gemisch mit Benzin als auch in reiner Form eingesetzt werden. Allerdings dürfte es kaum möglich sein, Benzin durch Bioethanol in merklichen Anteilen zu ersetzen. Im Jahr 2008 wurden weltweit etwa 50 Mio. t Bioethanol hergestellt, davon ca. 25 Mio. t in den USA auf der Basis von Maisstärke und ca. 20 Mio. t in Brasilien aus Zuckerrohr. Die Menge in den USA deckt aber nur etwa 5 % des Gesamtbenzinbedarfs!
Durch seine keimtötende Wirkung wird er auch als Desinfektions- und Konservierungsmittel eingesetzt. In der chemischen Industrie ist er ein wichtiger Ausgangsstoff zur Gewinnung vieler Chemikalien, wie z. B. Ethanal, Chlorethen (), Butadien, Ether, Essigester vielen Farbstoffen. Zur Herstellung einiger pharmazeutischer Präparate ist ebenso Ethanol nötig.
-
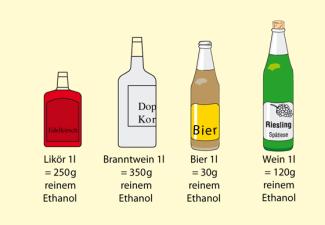
Alkoholgehalt verschiedener alkoholischer Getränke, absolute Menge in einem Liter