Feuerlöscher
Bricht ein Brand aus, verhindert schnelles Handeln oft größere Schäden und eine Ausbreitung des Brandes. Daher sind in öffentlichen Einrichtungen und auch in der Schule Feuerlöscher an leicht zugänglichen Stellen aufzustellen und durch gut sichtbare Hinweisschilder zu kennzeichnen. Auch wenn diese Geräte mit einer einfachen Bedienungsanleitung versehen sind, ist es günstig, sich schon vorbeugend mit der Funktionsweise und Handhabung zu beschäftigen.
Ein Feuer kann entstehen, wenn folgende drei Bedingungen erfüllt sind:
- ein brennbarer Stoff ist vorhanden,
- Luft- bzw. Sauerstoffzufuhr
- Erreichen der Entzündungstemperatur des brennbaren Stoffes.
Im Falle eines Brandes ist sofort die Feuerwehr unter der Notfallnummer 112 zu rufen und die Sicherheit der Personen zu gewährleisten.
Zum Löschen des Brandes sollte man versuchen mindestens eine der oben genannten Bedingungen nicht mehr zu gewährleisten. Schnelles Handeln verhindert oft größere Schäden und eine Ausbreitung des Brandes. Daher sind in öffentlichen Einrichtungen und auch in der Schule Feuerlöscher an leicht zugänglichen Stellen aufzustellen und durch gut sichtbare Hinweisschilder zu kennzeichnen.
Als Feuerlöscher bezeichnet man entsprechende Geräte mit einem maximalen Gewicht von 20 kg und für das Löschen von Kleinbränden und Entstehungsbränden geeignet sind. Sie enthalten Löschmittel, die bei Inbetriebnahme durch Druck auf den Brandherd gebracht werden. In den Feuerlöschern sind unterschiedliche Löschmittel enthalten, die jeweils zum Löschen bestimmter Brände geeignet sind.
Löschmittel Wasser bzw. Schaum: Das Löschmittel Wasser ist geeignet für Brände von Holz, Kohle Papier, Textilien usw (Brandklasse A). Durch das Wasser wird die Temperatur unter die Entzündungstemperatur der brennbaren Stoffe herabgesetzt. In gewisser Weise erfolgt auch ein Luftabschluss.
Wird dem Wasser noch ein Schaumbildner hinzugesetzt, bildet sich Schaum als Löschmittel, der die Luftzufuhr besser verhindert als reines Wasser. Mit Schaumlöscher können neben den benannten Bränden auch Brände der Bandklasse B ( Wachsbrände und Benzinbrände) bekämpft werden
Löschmittel Kohlenstoffdioxid : Es ist geeignet für Benzin- und Wachsbrände, Brände von Kunststoffen (Brandklasse B). Die Löschwirkung tritt ein, weil Kohlenstoffdioxid den Brandherd von der Luft bzw. dem Sauerstoff abschließt und selbst nicht brennbar ist.
Löschmittel Pulver: Bei diesen Löschmitteln handelt es sich um verschiedene Chemikalien, meistens um pulverförmige Salze wie Kalium- oder Natriumhydrogencarbonat, die im Gemisch mit anderen Stoffen vorliegen. In den meisten Handfeuerlöschern ist sogenanntes ABC-Pulver enthalten. Das bedeutet, dass diese Löschmittel zum Löschen von Bränden der Brandklasse A (Holz, Kohle, Kohle, Papier, Textilien), Brandklasse B (u. a. Wachs, Benzin, Teer, Alkohol) und Brandklasse C (Gase, wie Ethin, Wasserstoff und Erdgas) zum Einsatz kommen können.
Spezielle Pulverlöscher sind zum Löschen von Metallbränden (z. B. Magnesium - Brandklasse D) geeignet.
Funktionsprinzip eines Feuerlöschers
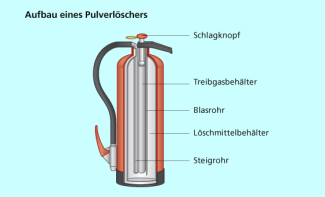
Jeder Feuerlöscher ist mit einer Betriebsleitung versehen, mit deren Hilfe eine Bedienung des Gerätes einfach ist.
- Die Sicherungslasche oder -stift wird abgezogen. Diese ist meist gelb gekennzeichnet.
- Der Schlag- oder Auslöseknopf (1) ist rot gekennzeichnet. Er wird durch einen Schlag gegen den Widerstand nach unten gedrückt.
- Durch den Schlag wird die Membran durchstoßen, die den Treibmittelbehälter (2) verschließt.
- Das Treibmittel gelangt über das Blasrohr (3) in den Löschmittelbehälter (4).
- Durch den Überdruck wird das Löschmittel über das Steigrohr (5) nach außen gepresst.
- Zum dosierten Abgeben sind die meisten Feuerlöscher mit einer sogenannten Löschpistole ausgerüstet.
Mithilfe dieser Löschmittelpistole kann das Löschmittel gezielt auf den Brandherd gelenkt werden. Dabei ist zu beachten, dass man mit der Wind- oder Zugrichtung löscht, weil man sich selbst ansonsten durch den Rauch gefährdet und eine Rauchvergiftung riskiert. Zudem sollte der Brand von unten nach oben bzw. von vorn nach hinten gelöscht werden.
-
Prinzipieller Aufbau eines Pulverlöschers