Formel und Benennung organischer Stoffe
Auch wenn die Gruppe der organischen Verbindungen, die aus den Elementen Kohlenstoff und Wasserstoff bestehen, schon sehr groß ist, würde es auf ihrer Grundlage wohl kein Leben auf unserem Planeten geben. Denn mit dem Einbau von Atomen weiterer Elemente, beispielsweise Atome der Elemente Sauerstoff, Stickstoff und Schwefel, nimmt die Molekülvielfalt noch einmal stark zu. Diese Heteroatome gehören oft speziellen funktionellen Gruppen an und werden bei der Benennung organischer Stoffe besonders berücksichtigt.
Organische Verbindungen besitzen nur im einfachsten Fall ausschließlich Kohlenstoff- und Wasserstoffatome in ihrem Molekül. Die große Masse der organischen Verbindungen enthält neben Wasserstoff- und Kohlenstoffatomen oftmals auch Sauerstoff-, Stickstoff-, Schwefel- oder Halogenatome.
Grundsätzlich gelten die Regeln der Nomenklatur, die für die Kohlenwasserstoffe gültig sind, auch für die Stoffe, die weitere Elemente enthalten.
Es ist aber auch entscheidend, wie die Atome anderer Elemente in den Molekülen angeordnet sind und welche besonderen Strukturen herausgebildet werden, deshalb müssen sie bei der Benennung Berücksichtigung finden. Häufig beeinflussen diese Atome oder Atomgruppen die Eigenschaften der jeweiligen Stoffe stark. Dann bezeichnet man sie als funktionelle Gruppen. Man kann sie schon im fachsystematischen Namen des Stoffes erkennen. Haben Stoffe die gleiche funktionelle Gruppe, so werden sie zu einer Stoffklasse zusammengefasst.
Organische Verbindungen mit Sauerstoffatomen im Molekül
Alkohole: Die charakteristische funktionelle Gruppe der Alkohole ist die Hydroxylgruppe (-OH). Sauerstoff wird zwischen einem Kohlenstoff- und Wasserstoffatom eingebaut. Im Namen erkennt man diese funktionelle Gruppe an der Endung -ol.
Beispiel Ethanol: Der Name sagt aus, dass es sich um ein Sauerstoffderivat des Ethans handelt. Die Kohlenstoffkette besteht aus zwei Kohlenstoffatomen, die über Einfachbindung miteinander verbunden sind. Ein Wasserstoffatom ist durch eine Hydroxylgruppe ersetzt.
Schon ab einer Kohlenstoffkette von drei Kohlenstoffatomen gibt es Isomere, was in der Benennung deutlich werden muss. Die Stellung im Molekül wird ähnlich der der Seitenketten von Kohlenwasserstoffen ermittelt. Die Bezeichnung ist ebenfalls vergleichbar. Die Stellung der Gruppen im Molekül wird durch arabische Ziffern angegeben.
Beispiel Propan-2-ol: Der Name sagt aus, dass es sich um ein Sauerstoffderivat des Propans handelt. Die Kohlenstoffkette besteht aus drei Kohlenstoffatomen, die über Einfachbindungen miteinander verbunden sind. Ein Wasserstoffatom des zweiten Kohlenstoffatoms in der Kette ist durch eine Hydroxylgruppe ersetzt.
Am Beispiel der Alkohole soll kurz darauf verwiesen werden, dass natürlich auch hier nicht nur eine, sondern mehrere funktionelle Gruppen im Molekül vorhanden sein können, ihre Anzahl wird durch griechische Zahlwörter angegeben.
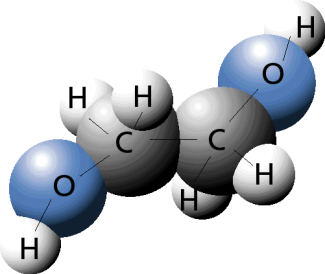
Beispiel Ethan-1,2-diol: Der Name sagt aus, dass es sich um ein Sauerstoffderivat des Ethans handelt. Die Kohlenstoffkette besteht aus zwei Kohlenstoffatomen, die über Einfachbindung miteinander verbunden sind. Jeweils ein Wasserstoffatom des ersten und des zweiten Kohlenstoffatoms in der Kette ist durch eine Hydroxylgruppe ersetzt.
Aldehyde: Die charakteristische funktionelle Gruppe der Aldehyde ist die Aldehydgruppe (-CHO). Diese Gruppe befindet sich immer am Ende einer Kette. Im Namen erkennt man diese funktionelle Gruppe an der Endung -al.
Beispiel Ethanal: Der Name sagt aus, dass es sich um ein Sauerstoffderivat des Ethans handelt. Die Kohlenstoffkette besteht aus zwei Kohlenstoffatomen, die über Einfachbindung miteinander verbunden sind. Eines dieser Kohlenstoffatome bildet mit einem Sauerstoffatom, mit dem es über eine Doppelbindung verbunden ist, und mit einem Wasserstoffatom eine Aldehydgruppe.
Carbonsäuren: Die charakteristische funktionelle Gruppe der Carbonsäuren ist die Carboxylgruppe (-COOH). In dieser Carboxylgruppe ist ein Kohlenstoffatom über eine Doppelbindung mit einem Sauerstoffatom verbunden. Außerdem befindet sich ein weiteres Sauerstoffatom zwischen einem Kohlenstoffatom und einem Wasserstoffatom. Im Namen kann man im Allgemeinen dieses besondere Strukturmerkmal am Wortteil -säure erkennen.
Beispiel Ethansäure: Der Name sagt aus, dass es sich um ein Sauerstoffderivat des Ethans handelt. Die Kohlenstoffkette besteht aus zwei Kohlenstoffatomen, die über Einfachbindung miteinander verbunden sind. Eines dieser Kohlenstoffatome bildet mit zwei Sauerstoffatomen und einem Wasserstoffatom die charakteristische Carboxylgruppe.
Ketone: Die charakteristische funktionelle Gruppe der Ketone ist die Ketogruppe (>CO). In dieser Gruppe ist das Sauerstoffatom mit dem Kohlenstoffatom über eine Doppelbindung verbunden. Das Kohlenstoffatom ist an den beiden anderen Bindungsstellen jeweils mit einem weiteren Kohlenstoffatom verknüpft. Folglich muss das einfachste Keton mindestens drei Kohlenstoffatome besitzen. Im Namen wird diese besondere Gruppe durch die Endung -on verdeutlicht.
Beispiel Propanon: Der Name sagt aus, dass es sich um ein Sauerstoffderivat des Propans handelt. Die Kohlenstoffkette besteht aus drei Kohlenstoffatomen, die über Einfachbindungen miteinander verbunden sind. Das mittlere dieser Kohlenstoffatome (zweites Kohlenstoffatom der Kette) ist mit einem Sauerstoffatomen über eine Doppelbindung verbunden.
Ether: Die charakteristische funktionelle Gruppe der Ether ist die Ethergruppe
. Über das Sauerstoffatom sind zwei Kohlenstoffketten miteinander verknüpft, wobei zwischen dem jeweiligen Kohlenstoffatom und dem Sauerstoffatom eine Einfachbindung existiert. Im Namen des Stoffes wird diese besondere Struktur durch den Wortteil -ether deutlich.
Beispiel Dimethylether: Es handelt sich um eine organische Verbindung, bei der zwei Methylgruppen durch die Ethergruppe miteinander verküpft sind.
Ester: Die charakteristische funktionelle Gruppe der Ester ist die Estergruppe (-COOC-). Ester entstehen hauptsächlich bei der Reaktion von Alkoholen mit Carbonsäuren unter Wasserabspaltung. In der Estergruppe ist ein Kohlenstoffatom mit einem Sauerstoffatom über eine Doppelbindung verknüpft. Mit einem anderen Sauerstoffatom existiert eine Einfachbindung. Das Sauerstoffatom hat eine weitere Einfachbindung zu einem anderen Kohlenstoffatom ausgebildet, sodass die beiden Molekülreste über dieses Sauerstoffatom miteinander verknüpft sind. Der Namen des Esters bildet sich aus dem Namen der Carbonsäure, der Bezeichnung für den Alkylrest des Alkohols und den Wortteil -ester.
Beispiel Methansäureethylester: Es handelt sich um einen Ester, bei dem der Molekülrest der Carbonsäure ein Kohlenstoffatom (verbunden dem dazugehörigen Wasserstoffatom) enthält, welches gleichzeitig zur Estergruppe gehört. Über diese Estergruppe ist ein Ethylrest (Rest des Ethanols) gebunden. Die Kohlenstoffkette des Alkylrestes enthält zwei Kohlenstoffatome, die über Einfachbindung miteinander verknüpft sind.
-
Kalottenmodell von Ethan-1,2-diol
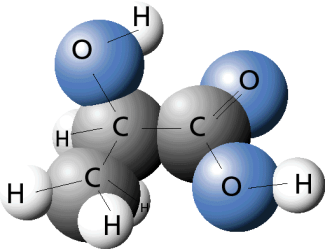
Es gibt natürlich auch organische Verbindungen, die nicht nur zwei oder mehrere gleichartige funktionelle Gruppen im Molekül aufweisen, sondern auch verschiedene funktionelle Gruppen besitzen. Ein Beispiel dafür sind die Moleküle der Milchsäure. Häufig verwendet man für solch kompliziert gebaute Verbindungen Trivialnamen. An den fachsystematischen Namen erkennt man jedoch besser den strukturellen Bau der Verbindungen. Für die Milchsäure lautet der fachsystematische Name 2-Hydroxypropansäure.
Organische Verbindungen mit Stickstoffatomen im Molekül
Stickstoff kommt in organischen Verbindungen sehr häufig vor, besonders bei lebender Materie. Wie alle Pflanzen und Tiere benötigt auch der Mensch das Element Stickstoff, speziell zum Aufbau der lebensnotwendigen Proteine und Aminosäuren. In diesen liegt er hauptsächlich chemisch gebunden in Aminogruppen vor .
Amine: Die charakteristische funktionelle Gruppe der Amine ist die Aminogruppe
. Diese ist einfach genommen ein Abkömmling (Derivat) des Ammoniaks . Im Namen ist sie am Wortteil -amin erkennbar.
Beispiel Ethylamin: Es handelt sich um ein Derivat des Ethans. Die Kohlenstoffkette besteht aus zwei Kohlenstoffatomen, zwischen denen Einfachbindung herrscht. Ein Wasserstoffatom ist durch eine Aminogruppe ersetzt.
-
Milchsäure ist 2-Hydroxypropansäure.
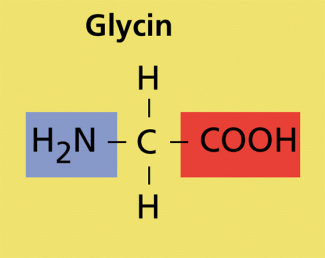
Aminosäuren: Aminosäuremoleküle weisen zwei charakteristische Gruppen auf. Neben der Aminogruppe existiert noch eine Carboxylgruppe. Bedingt durch diese beiden Gruppen kann die Peptidbindung ausgebildet werden. Das ist ebenfalls eine funktionelle Gruppe, die ein Stickstoffatom enthält.
Häufig werden bei Aminosäuren die Trivialnamen verwendet, wie z.B. bei Glycin. Der fachsystematisch korrekte Name lautet
2-Aminoethansäure.
Organische Verbindungen mit Halogenatomen im Molekül
Viele organische Verbindungen mit Chloratomen oder Fluoratomen im Molekül gehören zu den FCKW (Fluorchlorkohlenwasserstoffe). Sie treten nicht natürlich auf und wurden in den 20er Jahren des 20. Jahrhunderts das erste mal technisch hergestellt. Damals galten sie als Wundermittel der Technik, da ihr Einsatzgebiet die gesamte technische und synthetische Chemie umfaßte. So wurden viele als Kühlmittel in Kühlschränken, als Treibmittel in Spraydosen, aber auch als Plaste verwendet. Heute werden viele dieser Stoffe durch andere ersetzt, weil sie die Ozonschicht schädigen.
Die Benennung der Halogenderivate der Kohlenwasserstoffe erfolgt analog zur Bezeichnung verzweigter Kohlenwasserstoffe.
- Durch arabische Ziffern wird die Stellung der Halogenatome im Molekül angegeben.
- Griechische Zahlwörter bezeichnen die Anzahl der Halogenatome.
- Der Name des Atoms wird als Wortteil mit aufgenommen.
- Anschließend steht die Bezeichnung der zugrunde liegenden Kohlenstoffkette.
Beispiel 1,2-Dichlorpropan: Es handelt sich um ein Derivat des Propans. Die Kohlenstoffkette besteht aus drei Kohlenstoffatomen, die durch Einfachbindungen miteinander verbunden sind. Am ersten und am zweiten Kohlenstoffatom wurde ein Wasserstoffatom jeweils durch ein Chloratom ersetzt.
-
Glycin ist 2-Aminoethansäure.