Gesetz Periodizität
Das von MENDELEJEW formulierte Gesetz der Periodizität besagt, dass sich die Eigenschaften der Elemente periodisch – also regelmäßig wiederkehrend - in Abhängigkeit von den Atomgewichten bzw. Massen ändern. Damit ist gemeint, dass in den Perioden und Hauptgruppen des PSE immer wiederkehrende Tendenzen der Elementeigenschaften zu beobachten sind. Dazu gehören die Änderungen der Atomradien, der Elektronegativität, des Metallcharakters und der Wertigkeit der Elemente.
Heute wissen wir, dass die Ursachen für die periodische Änderung der Eigenschaften im inneren Aufbau der Atome also der Kernladungszahl und der Besetzung der Elektronenschalen zu suchen sind.
Periodensystem der Elemente
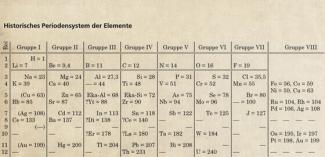
Die Chemiker DIMITRIJ MENDELEJEW und LOTHAR MEYER hatten 1869 die damals bekannten Elemente nach ihren Atommassen geordnet und daraus das erste Periodensystem der Elemente (PSE) aufgestellt. Insbesondere MENDELEJEW erkannte, dass sich die meisten Eigenschaften der Elemente in ähnlicher Weise bei schwereren Elementen mehrfach - also periodisch - wiederholen. Aufgrund der ähnlichen Eigenschaften ordnete er die Elemente in 8 Gruppen ein. Die VIII. Gruppe beinhaltete seinerzeit noch nicht die damals unbekannten Edelgase, sondern die heutigen Nebengruppenelemente (Bild 1).
MENDELEJEW formulierte das Gesetz der Periodizität , das besagt dass sich die Eigenschaften der Elemente periodisch - also regelmäßig wiederkehrend - in Abhängigkeit von den Atomgewichten bzw. Massen ändern.
Mithilfe dieses Gesetzes konnte er die seinerzeit noch unbekannten Elemente Gallium (Eka-Aluminium), Germanium (Eka-Silizium) und Scandium (Eka-Bor) mit ihren Eigenschaften relativ genau voraussagen. Die Leistungen MENDELEJEWS sind um so höher zu bewerten, als er damals nur über einfache Messmethoden verfügte und keinerlei Kenntnis über den inneren Bau der Atome besaß. MENDELEJEW und MEYER stellten ihr PSE auf der Basis des daltonschen Atommodells auf, d. h. sie kannten weder Protonen noch Elektronen!
Periodizität von Eigenschaften
Wir sind heute in einer weitaus komfortableren Situation. Wir wissen, dass die Ordnung im PSE nach dem Atomgewicht nicht ganz genau ist, sondern nach der Anzahl der Protonen erfolgt. Die Einordnung der Elemente in verschiedene Perioden und Gruppen hingegen ist durch ihre Elektronenkonfiguration, d. h. die Besetzung der Elektronenschalen bedingt. Daraus erklärt sich auch die Änderung der Eigenschaften der Elemente innerhalb des Periodensystems:
-
Historisches Periodensystem der Elemente vom Ende des 19. Jahrhunderts. Die Edelgase und einige andere Elemente waren noch nicht bekannt.
Eine Periode beginnt nach heutigem Erkenntnisstand immer dort, wo hinzukommende Elektronen ein höheres Energieniveau einnehmen, also eine weitere Elektronenschale besetzt wird. Dadurch ändern sich die Eigenschaften der Elemente sprunghaft (z. B. von Helium zu Lithium oder von Neon zu Natrium).
Innerhalb einer Periode nimmt die Anzahl der Elektronen in der Atomhülle zwar kontinuierlich zu, allerdings befinden sich die Außenelektronen in derselben Elektronenschale, d. h. im fast gleichen Abstand zum Kern. Die Kernladung nimmt jedoch mit jedem Element um eine Einheit (ein Proton) zu. Folglich steigt auch die Anziehung der Elektronen durch den positiv geladenen Kern innerhalb einer Periode. Entsprechend abgestuft ändern sich auch die Eigenschaften der Elemente innerhalb einer Periode (Bild 2).
Der am Beispiel der 2. und 3. Periode dargestellte Trend wiederholt sich in ähnlicher Weise auch bei den Hauptgruppenelementen der höheren Perioden.
- Innerhalb einer Periode nimmt der Atomradius mit der Kernladung kontinuierlich ab.
- Die Elektronegativität und die Elektronenaffinität steigen innerhalb einer Periode kontinuierlich an.
- Der Metallcharakter nimmt innerhalb einer Periode ab, während der Nichtmetallcharakter zunimmt.
- Gleiches gilt für den basischen bzw. sauren Charakter der Oxide. Metalle bilden basische Oxide, die mit Wasser zu Hydroxiden reagieren. Die Oxide der meisten Nichtmetalle reagieren in wässrigen Lösungen sauer.
Schon MENDELEJEW erkannte die Ähnlichkeit bestimmter Elemente und ordnete diese in gleiche Gruppen ein. Heute wissen wir, dass diese Ähnlichkeit dadurch bedingt ist, dass alle Elemente einer Gruppe über exakt die gleiche Anzahl an Außenelektronen bzw. Valenzelektronen verfügen. Diese Valenzelektronen bestimmen hauptsächlich die chemischen Eigenschaften, da sie an der Ausbildung der chemischen Bindungen beteiligt sind.
Auch innerhalb der Hauptgruppen kann man immer wiederkehrende Trends der Änderungen von Eigenschaften beobachten. Diese Periodizität ist jedoch anders gelagert als die Änderung innerhalb der Gruppen. Ursache ist in erster Linie, dass innerhalb der Gruppen zwar die Kernladung zunimmt, jedoch jedes schwerere Elementatom noch eine zusätzliche voll besetzte Elektronenschale enthält. Diese zusätzliche Schale schirmt die Valenzelektronen von der Ladung des Kerns ab, sodass die Außenelektronen immer lockerer gebunden sind.
Beispiel: Lithium- und Kaliumatome verfügen jeweils über ein Außenelektron. Das Kaliumatom gibt sein Valenzelektron jedoch trotz höherer Kernladung leichter ab als ein Lithiumatom, weil das Valenzelektron durch die K- und die L-Schale vom Kern abgeschirmt wird.
-
Innerhalb der Perioden ändern sich die Eigenschaften der Elemente immer wieder auf ähnliche Weise.

In jeder Hauptgruppe lassen sich wiederkehrenden Trends der Eigenschaften beobachten:
- Innerhalb einer Hauptgruppe nimmt der Atomradius mit der Anzahl der Elektronenschalen zu.
- Die Elektronegativität und die Ionisierungsenergie sinken mit wenigen Ausnahmen (Wasserstoff) kontinuierlich.
- Der Metallcharakter nimmt innerhalb einer Hauptgruppe zu, d. h. die Elemente der höheren Perioden bilden basische Oxide und weisen metallische Eigenschaften auf (Ausnahme VII. und VIII. Hauptgruppe).
- Der Nichtmetallcharakter ist hingegen bei den leichteren Elementen einer Hauptgruppe am stärksten ausgeprägt.
Die Wiederholung der allgemeinen Trends in den Perioden und in den Gruppen des PSE bezeichnet man als Periodizität der Eigenschaften.
Metall- und Nichtmetallcharakter
Alle Elemente streben danach, durch Abgabe oder Aufnahme von Elektronen oder durch Ausbildung chemischer Bindungen einen energetisch stabilen Zustand zu erreichen. Derartige Zustände sind die Achterschale des Neons sowie die vollständige Elektronenkonfiguration der anderen Edelgase.
Metalle sind dadurch gekennzeichnet, dass die Atome relativ wenige Außenelektronen aufweisen und die Ionisierungsenergie relativ gering ist. Da die Elektronen leicht abgegeben werden können, bilden sie positiv geladene Ionen. Die Anzahl der Ladung entspricht bei Hauptgruppenelementen der Hauptgruppennummer. Metalle sind im Periodensystem in Abhängigkeit von der Anzahl ihrer Außenelektronen links zu finden.
Die Anzahl der Außenelektronen von Atomen der Nichtmetalle ist relativ hoch. Entsprechend findet man sie im PSE rechts. Um Elektronen aus der Atomhülle herauszulösen, wäre eine erhebliche Ionisierungsenergie nötig. Daher bilden sie negativ geladene Ionen, indem Elektronen aufgenommen werden. Nichtmetalle sind auch daran erkennbar, dass sie Oxide bilden, die in Wasser sauer reagieren. Im Periodensystem stehen sie auf der rechten Seite, insbesondere bei den leichteren Elementen.
Zwischen den Metallen und Nichtmetallen findet man die Halbmetalle. Diese Elemente III. - V. Hauptgruppe bilden kaum Ionen, sondern wie Bor- und Siliciumatome gemeinsame Elektronenpaare mit anderen Atomen aus. Die Oxide der Halbmetalle können sowohl sauer als auch basisch reagieren.
Wertigkeit
Die Wertigkeit ist eine wichtige chemische Eigenschaft von Elementen, die jedoch nur schwer fassbar ist. Sie wird fälschlicherweise der Oxidationszahl oder Ionenladung gleichgesetzt, was jedoch nicht in allen Fällen zutrifft.
Die Wertigkeit gibt an, wie viele Fluor- bzw. Wasserstoffatome ein Atom oder Ion eines Elements theoretisch binden oder ersetzen kann. Die Wertigkeit wird hauptsächlich von der Valenzelektronenkonfiguration der Elemente bestimmt und auch als Valenz bezeichnet.
Mit jedem Valenzelektron kann ein Atom theoretisch eine Elektronen-paarbindung zu einem anderen Atom ausbilden. Alternativ dazu kann die Edelgaskonfiguration in Verbindungen auch durch Bildung von Ionen erreicht werden. Um die Ionenladung zu neutralisieren, muss eine entsprechende Anzahl entgegengesetzt geladener Ionen gebunden werden. Die Anzahl der Bindungspartner wird somit von der Anzahl der Außenelektronen eines Atoms bestimmt.
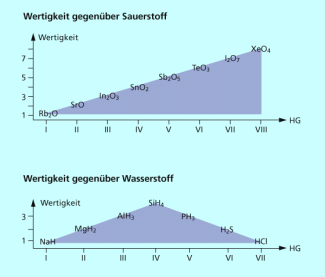
Von der I. bis zur VIII. Hauptgruppe steigt die Zahl der Außenelektronen kontinuierlich von 1 auf 8 an. Dieser Prozess wiederholt sich innerhalb jeder Periode, sodass die maximale Wertigkeit der Nummer der Hauptgruppe des Elements entspricht (Bild 4). Diese Regel gilt für die maximale Wertigkeit gegenüber Sauerstoff und Fluor mit einer Einschränkung. Die Elemente der 2. Periode verfügen nur über vier Atomorbitale und können deshalb maximal vier Bindungen ausbilden.
Die Wertigkeit der Hauptgruppenelemente gegenüber Wasserstoff steigt bis zur IV. Hauptgruppe an und nimmt dann wieder ab, d. h. man beobachtet einen sogenannten „Dacheffekt“ (Bild 4).
-
Wertigkeit von Elementen innerhalb einer Periode