Halbwertszeit
Eine wichtige Größe in der chemischen Kinetik ist die Halbwertszeit. Diese gibt an, nach welcher Zeit sich die Anfangskonzentration eines Ausgangsstoffes genau um die Hälfte verringert hat.
Die Halbwertszeit ist ein Begriff, der in der Kinetik und in der Kernchemie im gleichen Sinne benutzt wird. Sie entspricht der Zeit, nach der sich die Konzentration bzw. Stoffmenge eines Ausgangsstoffes (z. B. eines Radionuklids) auf genau die Hälfte verrringert hat. Eingeführt wurde der Begriff Halbwertszeit 1903 von dem französischen Kernphysiker PIERRE CURIE (1859-1906).
In der Kernchemie ist die Halbwertszeit eine stoffspezifische Größe, mit deren Hilfe sich u. a. das Alter von Gesteinen oder Fossilien aus dem radioaktiven Zerfallsgesetz bestimmen lässt.
Das radioaktive Zerfallsgesetz
Das Zerfallsgesetz gibt an, wie eine bestimmte Anzahl von Atomkernen eines radioaktiven Nuklids in Abhängigkeit von der Zeit zerfällt. Die Anzahl der zerfallenen Atomkerne ist abhängig
- von der Anzahl der ursprünglich vorhandenen Atomkerne des betreffenden Nuklids,
- von der Halbwertszeit des Nuklids,
- von der vergangenen Zeit.
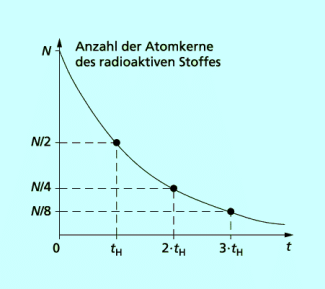
Anschaulich lässt sich der Zerfall von Atomkernen in Abhängigkeit von der Zeit in einer Zerfallskurve verdeutlichen. Es ergibt sich ein nicht linearer Zusammenhang. Ist eine Halbwertszeit vergangen, so ist noch die Hälfte der ursprünglich vorhandenen Atomkerne des Nuklids vorhanden. Die andere Hälfte ist zerfallen. Nach zwei Halbwertszeiten sind noch ein Viertel, nach drei Halbwertszeiten noch ein Achtel der ursprünglich vorhandenen Atomkerne vorhanden.
Der im Diagramm (Bild 1) dargestellte Zusammenhang lässt sich auch in Form einer Gleichung erfassen. Für den Zerfall von Atomkernen gilt der folgende quantitative Zusammenhang:
Die Halbwertszeit in der Kinetik
In der Kinetik wird der Begriff Halbwertszeit auf chemische Reaktionen wie z.B. die Zersetzung von Wasserstoffperoxid angewandt.
Dabei betrachtet man die Änderung der Konzentrationen von Edukt oder Produkt in einem bestimmten Zeitintervall. Je nachdem wie eine Reaktion abläuft unterscheidet man zwischen Reaktionen verschiedener Ordnung. Für die Geschwindigkeit einer chemischen Reaktion lassen sich entsprechend der Ordnung mathematische Gleichungen aufstellen. Durch Umformungen ergeben sich die Formeln für die Halbwetszeit. Dabei berückstichtigt man: ist eine Halbwertszeit vergangen, so ist die Hälfte des Eduktes (hier: Wasserstoffperoxid) zerfallen, d. h. die Konzentration entspricht der Hälfte der Anfangskonzentration. Die kinetische Halbwertszeit ist eine reaktionsspezifische Größe. Für Reaktionen 1. Ordnung wie den Zerfall von Wasserstoffperoxid ist die Halbwertszeit unabhängig von der Konzentration. Das bedeutet, egal wieviel von dem Edukt vorhanden ist, die Reaktion läuft immer gleich schnell. Die Formel lautet:
Für chemische Reaktionen 2. Ordnung ist die Halbwertszeit noch abhängig von der Konzentration des Eduktes. In diesem Fall läuft die Reaktion also schneller (oder langsamer) ab je mehr Edukt da ist. Das bedeutet auch, das sich die Reaktiosgeschwindigkeit im Laufe der Reaktion ändert, wenn das Edukt weniger wird. Die mathematischen Zusamenhänge werden dadurch etwas komplizierter.