Henry Le Chatelier
* 08.10.1850 in Paris
† 17.09.1936 Miribelle-Echelles
HENRY LE CHATELIER war ein französischer Chemiker und Ingenieur. Berühmt wurde er durch seine Untersuchungen zum chemischen Gleichgewicht. Er formulierte die Bedingungen zur Einstellung eines chemischen Gleichgewichts und das Prinzip des kleinsten Zwangs. Dieses besagt, dass sich das chemische Gleichgewicht einem äußeren Zwang immer so entzieht, dass die Wirkungen des äußeren Zwangs verkleinert werden.
Obwohl das Prinzip von LE CHATELIER nur qualitative Schlussfolgerungen zur Lage des chemischen Gleichgewichts zulässt, ist es speziell für Gleichgewichtsreaktionen in der chemischen Industrie von herausragender wirtschaftlicher Bedeutung.
Die Zeit, in der er lebte
In der zweiten Hälfte des 19. Jahrhunderts fanden in Europa und den USA bedeutende politische und wirtschaftliche Entwicklungen statt. Die industrielle Revolution griff von England auf ganz Europa über. Besonders Frankreich und Deutschland durchlebten stürmische Zeiten. In Frankreich kam es 1848 zu mehreren Auftsänden der Bevölkerung und zur Ausrufung der zweiten französischen Republik.
Bei den Präsidentschaftswahlen im gleichen Jahr wurde LOUIS-NAPOLEON BONAPARTE, Neffe des ersten Kaisers NAPOLEON BONAPARTE, zum Präsidenten gewählt. Dieser löste 1851 die Nationalversammlung wieder auf und verfolgte seine demokratisch gesinnten Gegner erbarmungslos. Nachdem der oppositionelle Widerstand gebrochen war, ließ sich der Neffe BONAPARTEs nach dem Vorbild seines Onkels am 2. Dezember 1852 zum Kaiser NAPOLEON III. krönen.
Im zweiten Kaiserreich entwickelte sich Frankreich vor allem wirtschaftlich zu einer Industrienation. NAPOLEON III. förderte die die Wissenschaften und die Kultur. Aufgrund außenpolitischer Niederlagen (mexikanischer Krieg und deutsch-österreichischer Krieg 1866) und einer weltweiten Wirtschaftskrise schwand jedoch die Macht des Kaisers. Er ließ sich auf den Deutsch-Französischen Krieg mit Preußen ein und erlitt 1870 bei Sedan eine vernichtende Niederlage.
Daraufhin kam es erneut zu einem Arbeiteraufstand in Paris, der zur Abdankung des Kaisers und zur Ausrufung der dritten französischen Republik führte. Diese führte den Krieg mit Preußen weiter und gab sich erst 1871 geschlagen. Daraufhin gab es erneute Unruhen in Paris und es kam zur Ausrufung der Pariser Kommune, die jedoch nach wenigen Wochen mit Unterstützung Preußens niedergeschlagen wurde. Erst danach entwickelte sich die 3. Republik zur dauerhaften Regierungsform in Frankreich.
Es ist aus heutiger Sicht mehr als erstaunlich, zu welchen Leistungen die Wissenschaft und die Industrie in diesen politisch stürmischen Zeiten fähig waren.
Die Erfindungen der Physiker WERNER VON SIEMENS und THOMAS EDINSON erlaubten die Versorgung von Städten und Industrieanlagen mit elektrischer Energie.
Die Erkenntnisse der Chemie wurden zunehmend ebenfalls industriell genutzt. Durch neue großtechnische Verfahren der Eisenherstellung, z. B. des BESSEMER-Verfahrens, wurde die Herstellung neuer und besserer Maschinen möglich. Der belgische Chemiker ERNEST SOLVAY schuf die technischen Voraussetzungen für die großtechnische Herstellung von Soda. ADOLF VON BAEYER gelang erstmals die Synthese des beliebten Naturfarbstoffs Indigo, er legte damit die Grundlage für dessen großtechnische Herstellung.
Neben der Entdeckung des Periodensystems der Elemente durch MENDELEJEW und MEYER und der Begründung der organischen Strukturchemie durch KEKULÉ erlebte besonders die physikalische Chemie eine bemerkenswerte Entwicklung. Die drei Hauptsätze der Thermodynamik wurden formuliert und die Grundlagen der Katalyse von OSTWALD systematisch untersucht und für großtechnische Prozesse genutzt.
Dass die zugrunde liegenden chemischen Reaktionen sehr oft Gleichgewichtsreaktionen sind, erkannte man frühzeitig.
Da es von herausragendem wirtschaftlichen Interesse war, diese Prozesse mit möglichst hohen Ausbeuten zu fahren, wurde der Einfluss der Reaktionsbedingungen auf die Lage der Gleichgewichte intensiv untersucht. Einer der Pioniere auf diesem Gebiet war der junge französische Chemiker und Ingenieur HENRY LE CHATELIER.
Leben und Leistungen
LE CHATELIER wurde am 08.10.1850 in Paris als Sohn eines Bergbauingenieurs geboren. Seine Jugend verbrachte er in der Stadt an der Seine, wo er 1870 an der Ècole Polytechnique zu studieren begann. Neben dem Studium arbeitete er im chemischen Labor von CLAIRE DEVILLE und erhielt dadurch eine umfassende Ausbildung in Naturwissenschaften und Technik.
Nach kurzer Tätigkeit als Bergbauingenieur erkannte er seine eigentliche Berufung zur Chemie und wurde 1877 Lehrer an der Ècole de Mines in Paris, an der er selbst einige Jahre studiert hatte. An dieser Ausbildungsstätte für Bergbauingenieure und Metallurgen beschäftigte sich LE CHATELIER vor allem mit chemisch-technischen Problemen.
Er untersuchte Verbrennungsprozesse und deren effektive Bekämpfung bei den damals in den Kohlegruben und anderen Minen häufig auftretenden Schlagwetterkatastrophen. In diesem Zusammenhang bestimmte LE CHATELIER die spezifische Wärme von Gasen und Flammentemperaturen. Er fand als einer der Ersten heraus, dass die spezifische Wärme von Gasen mit steigender Temperatur zunimmt.
Um 1880 begann er, sich intensiver der Energieumwandlung bei chemischen Reaktionen – und damit der chemischen Thermodynamik – zu widmen. LE CHATELIER wies nach, dass durch chemische Reaktionen Arbeit verrichtet werden kann und nannte die freie Energie, die bei einer Reaktion in Arbeit umgewandelt werden kann, „bewegende Kraft“.
Berühmt wurde er durch seine Untersuchungen zum chemischen Gleichgewicht. Daraus leitete LE CHATELIER die Bedingungen für die Einstellung eines chemischen Gleichgewichts ab:
- Eein chemisches Gleichgewicht kann sich nur in einem geschlossenen System einstellen.
- Die chemische Reaktion muss reversibel sein, d. h. Hin- und Rückreaktion müssen gleichzeitig und ungehemmt erfolgen.
-
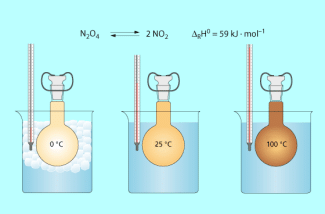
Beeinflussung der Lage eines Gleichgewichts durch Temperatur und Druck nach HENRY LE CHATELIER (1850-1936)

Außerdem erkannte er, auf welche Weise die Reaktionsbedingungen Temperatur und Druck die Lage des chemischen Gleichgewichts beeinflussen. 1887 formulierte er danach das Prinzip des kleinsten Zwangs, das nahezu zeitgleich auch vom Physiker KARL FERDINAND BRAUN (1850-1918) entdeckt wurde. Dieses Prinzip – heute auch als Prinzip von LE CHATELIER bekannt – erlaubt qualitative Aussagen zur Abhängigkeit der Lage eines Gleichgewichts von der Temperatur und dem Druck. Es besagt:
Übt man auf ein im Gleichgewicht befindliches stoffliches System einen Zwang aus, so verschiebt sich das Gleichgewicht so, dass das System dem äußeren Zwang ausweicht, wobei dessen Wirkungen verringert werden.
Obwohl dieses Prinzip erst 20 Jahre nach dem Massenwirkungsgesetz (MWG) von GULDBERG und WAAGE formuliert wurde und im Gegensatz zu dieser mathematischen Gleichung nur qualitative Schlussfolgerungen zur Lage des Gleichgewichts zulässt, hat es dennoch enorme Bedeutung insbesondere für die chemische Industrie, z. B. für die Synthesen von Ammoniak und Schwefelsäure.
Das liegt unter anderem daran, dass das MWG als mathematische Gleichung viele Jahre nicht beachtet und seine herausragende Bedeutung erst Ende des 19. Jahrhunderts von OSTWALD und VAN'T HOFF erkannt wurde. Außerdem ist das phänomenologische Prinzip von LE CHATELIER leicht verständlich.
LE CHATELIER wurde durch diese Forschungen weltbekannt und hielt ab 1898 Vorlesungen am Collège de France. Später erhielt er einen Ruf als Professor für Chemie an die berühmte Pariser Universität Sorbonne.
Wissenschaftlich wandte er sich der Metallurgie zu, der er seit seinem Studium an der Ècole de Mines eng verbunden war. Nachdem LE CHATELIER ein neues bis heute vielfach genutztes Platin-Rhodium-Thermoelement entwickelt hatte, beschäftigte sich der Franzose mit der thermischen Analyse von Stählen und anderen Legierungen. Seine Arbeiten zur Veränderung der Eigenschaften durch spezielle thermische Behandlungen von Stählen waren von enormer Bedeutung für die Werkstoffkunde und Metallurgie.
Im Alter von 69 Jahren gab LE CHATELIER sein Lehramt an der Sorbonne auf und verbrachte seinen Lebensabend in der Provence. Hier starb er am 17. September 1936 in Miribelle-Echelles.
-
Die Reaktionstemperatur beeinflusst das Konzentrationsverhältnis der im Gleichgewicht liegenden Gase: farbloses Distickstofftetraoxid und dunkelbraunes Stickstoffdioxid.