Interpretieren, Reaktionsgleichungen
Interpretieren ist eine Tätigkeit, eine verbale Aussage, die eng mit dem Experimentieren sowie mit Gleichungen und Diagrammen verbunden ist.
Beim Interpretieren von Reaktionsgleichungen wird den Zeichen und Symbolen sowie den dargestellten Sachverhalten eine inhaltliche Bedeutung zugeordnet.
Beim Interpretieren wird die Bedeutung einer verkürzt bzw. komprimiert dargestellten Aussage mit sprachlichen Mitteln in einem umfassenden, leicht verständlichen Zusammenhang dargestellt.
Beim Interpretieren von Reaktionsgleichungen werden qualitative und quantitative Aussagen zum Stoffumsatz und zur Art der chemischen Reaktion abgeleitet. Dabei geht es darum, den Inhalt der Gleichung zu erfassen und eventuell auch Folgerungen daraus abzuleiten. Unter Berücksichtigung der thermodynamischen und kinetischen Daten der Gleichung können außerdem Schlussfolgerungen zur Lage und zur Beeinflussung des chemischen Gleichgewichts durch die Reaktionsbedingungen gezogen werden. Auch den Energieumsatz einer Reaktion kann man angeben. Die Reaktionswärme wird hinter der Gleichung vermerkt. Ein Pluszeichen kennzeichnet die endotherme, ein Minuszeichen die exotherme Reaktion.
Aus chemischen Reaktionsgleichungen lassen sich Aussagen über die reagierenden Teilchen und quantitative Angaben ableiten.
| A) | Qualitative Interpretation (reagierende Teilchen): Bei dieser Interpretation gibt man die Anzahl, die Art und den Namen der reagierenden Teilchen an. Sind Ionen an der chemischen Reaktion beteiligt, so werden deren Ladungen mit berücksichtigt. |
![]()
| B) | Quantitative Interpretation (Stoffmengen): Bei der quantitativen Interpretation werden den Faktoren in der Reaktionsgleichung die entsprechenden Stoffmengen zugeordnet. |
![]() Beim Interpretieren von Reaktionsgleichungen geht man folgendermaßen vor:
Beim Interpretieren von Reaktionsgleichungen geht man folgendermaßen vor:
| 1. | Formulieren des Stoffumsatzes der Edukte und Produkte in ihren Aggregatzuständen |
| 2. | Analysieren der Reaktionsart |
| 3. | Betrachten des chemischen Gleichgewichts und der konkreten Reaktionsbedingungen |
| 4. | Ableiten von Schlussfolgerungen unter Berücksichtigung thermodynamischer und kinetischer Besonderheiten |
Beispiel:
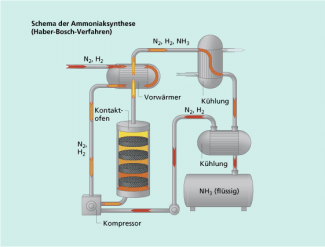
Interpretieren Sie die Reaktionsgleichung der Ammoniaksynthese!
| 1. | Die Gase Stickstoff und Wasserstoff reagieren in einem Stoffmengenverhältnis von zu ebenfalls gasförmigem Ammoniak. Aus 4 mol Ausgangsstoffen entstehen 2 mol Reaktionsprodukt, sodass die Reaktion unter Volumenverkleinerung stattfindet. |
| 2. | Da sich die Oxidationszahlen des Stickstoffs und des Wasserstoffs ändern, handelt es sich um eine Redoxreaktion. Stickstoff nimmt Elektronen auf und wird dabei reduziert, während Wasserstoff unter Elektronenabgabe oxidiert wird. |
| 3. | Aus dem doppelten Reaktionspfeil und der Angabe einer Gleichgewichtskonstante ist ersichtlich, dass es sich um eine Gleichgewichtsreaktion handelt. Die Gleichgewichtskonstante ist kleiner 1, sodass das Gleichgewicht unter den Reaktionsbedingungen auf der Seite der Ausgangsstoffe liegt. |
| 4. | Die Reaktion wird bei einer Temperatur von 400 °C und einem Druck von 30 MPa durchgeführt. Aufgrund der Volumenverkleinerung wirkt sich der hohe Druck positiv auf die Bildung des Ammoniaks aus. Die Reaktion ist exotherm, da die Reaktionsenthalpie negativ ist. Bei der Umsetzung von 1 mol Stickstoff werden 92 kJ Wärme freigesetzt. Infolge der exothermen Reaktion wirkt sich die hohe Temperatur ungünstig auf den Anteil von Ammoniak im Gleichgewicht aus. |
| 5. | Die Verwendung eines Katalysators weist darauf hin, dass die Reaktion unter Normalbedingungen (T = 298 K, p = 101,3 kPa) nur relativ langsam abläuft. Die notwendige Beschleunigung der Umsetzung ist der Grund für die hohe Reaktionstemperatur.
|
-
Schema der technischen Anlage zur Ammoniaksynthese