Magensäure
Salzsäure hat als Magensäure in diesem Verdauungsorgan wichtige Funktionen. Chemisch gesehen handelt es sich bei der Salzsäure um eine sehr starke Säure. Sie ist ätzend und reagiert mit vielen Stoffen, beispielsweise mit unedlen Metallen. Aber auch organische Substanz werden angegriffen. Ein Schluck aus einer Salzsäureflasche hätte gefährlichen Folgen für den Betroffenen! Wie gelangt so eine ätzende Substanz in unseren Magen und warum wird er nicht zerstört?
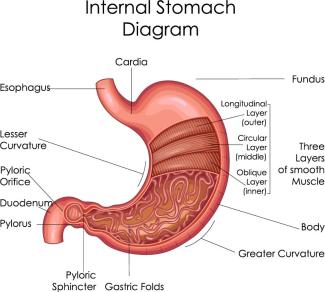
Der Magen ist ein Teil des Verdauungssystems. Über die Speiseröhre gelangt der Nahrungsbrei in dieses innere Organ, welches ein gewisses Volumen aufnehmen kann. Im Inneren ist es durch eine gut ausgebildete Schleimhaut ausgekleidet, die einen zähen Schleim ausbildet. Zudem wird aus speziellen Drüsen der Magenschleimhaut Gastrin und Pepsinogen (eine Vorstufe des Pepsins) in den Mageninnenraum abgegeben. Eine Besonderheit der Drüsen stellen sogenannte Belegzellen dar.
Der Magen dient als Reservoir für den Nahrungsbrei und kann ein Volumen von bis zu 1,5 Liter aufnehmen. Im Magen erfolgen eine Vermischung des Breis und sein Weitertransport. Außerdem beginnt hier die chemische Zerkleinerung der Eiweiße, die in der Nahrung enthalten sind. Langkettige und komplex gebaute Eiweiße werden zu Peptiden mit kürzeren Ketten abgebaut. Der Prozess wird im Magen vom Pepsin katalysiert. Dieses Eiweiß spaltende Enzym entsteht im Magen aus seiner Vorstufe. Pepsin erreicht seine Wirksamkeit jedoch nur bei einem relativ niedrigen pH-Wert. Optimal ist ein Wert zwischen 1,0 und 4,0. Dieser niedrige pH-Wert wird durch die Magensäure realisiert. Dabei handelt es sich um Salzsäure mit einem pH-Wert von ungefähr 0,9 bis 2,0.
-
Magen des Menschen
vecton - adobe stock
Außerdem hat die Magensäure auch weitere unmittelbare Funktionen. Ihre Säurewirkung auf biologisches Gewebe führt dazu, dass viele mit der Nahrung aufgenommene Mirkoorganismen abgetötet werden. Zudem bewirkt die Magensäure eine Gerinnung der Eiweiße, die in der Nahrung enthalten sind und erleichtert so den Aufschluss der Eiweiße, die sogenannte Hydrolyse.
Chemisch gesehen handelt es sich bei der Salzsäure um eine sehr starke Säure. Sie ist ätzend und reagiert mit vielen Stoffen, beispielsweise mit unedlen Metallen. Aber auch organische Substanzen werden angegriffen. Ein Schluck aus einer Salzsäureflasche hätte gefährlichen Folgen für den Betroffenen!
Offensichtlich wird die Salzsäure erst im Magen selbst gebildet, da sie nicht direkt mit der Nahrung aufgenommen werden kann. Dafür sind die oben erwähnten Belegzellen zuständig.
Für die biochemische Synthese der Salzsäure (HCl) in den Belegzellen sind Wasserstoff-Ionen (Hydronium-Ionen) und Chlorid-Ionen erforderlich.
Die Chlorid-Ionen entstammen der aufgenommenen Nahrung. Beispielsweise ist Kochsalz ein Lieferant von Chlorid-Ionen.
Zudem wird in den Belegzellen Kohlensäure gebildet. Bei ihrer Reaktion mit Wasser entstehen die benötigten Wasserstoff-Ionen (Hydronium-Ionen).
Die für die Synthese der Salzsäure nicht benötigten Natrium-Ionen (aus dem Kochsalz) und die Hydrogencarbonat-Ionen (aus der Kohlensäure) werden in das Blut abgegeben.
Die produzierte Salzsäure wird von den Belegzellen in den Mageninnenraum abgegeben und unterstützt dort die Verdauung der Nahrung.
Die Magenschleimhaut selbst wird von der Salzsäure normaler Weise nicht angegriffen, weil sie durch den zähen Schleim, der der gesamten Mageninnenwand aufliegt, vor der Selbstverdauung geschützt ist. Allerdings kann es bei Verletzungen dieser Schicht zu Magengeschwüren kommen.
Ältere Menschen haben manchmal Probleme damit, dass der Verschlussmechanismus des Magens (der sogenannte Ösophagussphinkter) nicht mehr richtig funktioniert. Dann kann Magensäure in die Speiseröhre zurückfließen und die Schleimhäute sowie das organische Gewebe angreifen. Der Betroffene empfindet einen Schmerz, der im Volksmund als Sodbrennen bezeichnet wird.

