Naturkonstanten
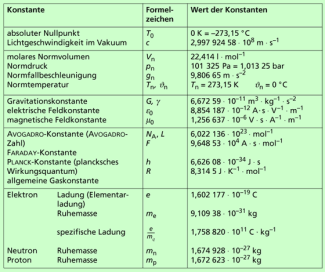
Einige Größen in der Natur haben einen bestimmten, festen Wert, der im Laufe der Zeit immer genauer bestimmt worden ist. Man nennt solche Größen auch Naturkonstanten. Typische Beispiele für solche Naturkonstanten sind die Lichtgeschwindigkeit im Vakuum als die größtmögliche in der Natur auftretende Geschwindigkeit, der absolute Nullpunkt der Temperatur als die tiefstmögliche Temperatur oder die AVOGADRO-Konstante als die Anzahl der Teilchen, die in einem Mol eines Stoffes enthalten sind.
Weitere Naturkonstanten sind z. B. die Gravitationskonstante, das plancksche Wirkungsquantum oder die Ladung und die Masse eines Elektrons.
Eine Übersicht über wichtige Naturkonstanten ist in Bild 1 gegeben.
-
Naturkonstanten
Lernhelfer (Duden Learnattack GmbH): "Naturkonstanten." In: Lernhelfer (Duden Learnattack GmbH). URL: http://www.lernhelfer.de/schuelerlexikon/chemie/artikel/naturkonstanten (Abgerufen: 10. March 2026, 19:48 UTC)

