Organische Elementaranalyse
Die Identifizierung organischer Verbindungen mit einfachen Nachweisreaktionen ist nicht besonders eindeutig , da man oft nur Hinweise auf die Stoffklasse erhält. Deshalb bestimmt man in der Organik die Zusammensetzung der Substanzen quantitativ. Dies ist wesentlich einfacher als in der Anorganik, da die meisten organischen Moleküle aus den Elementen Kohlenstoff, Wasserstoff, Sauerstoff und Stickstoff bestehen. Nur wenige Moleküle enthalten noch weitere Heteroatome wie Halogenatome (F, Cl, Br, I) oder Schwefel und werden noch weiteren Untersuchungen unterzogen.
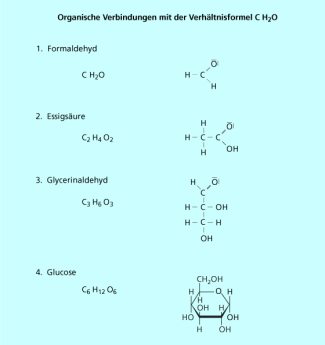
Bei der Elementaranalyse oder CHN-Analyse werden die Gewichtsprozente der chemischen Elemente in organischen Verbindungen bestimmt und daraus die Verhältnisformel berechnet.
Es gibt heute ca. 10 Millionen organische Verbindungen und täglich kommen mehrere Hundert dazu. Die Identifizierung dieser Stoffe durch einzelne, stoffspezifische Reaktionen ist kaum möglich. In der modernen Analytik erfolgt die Identifizierung daher mittels strukturanalytischer Methoden (IR-, NMR-Spektroskopie, Massesnspektrometrie usw.).
Allerdings ist die Bestimmung der quantitativen Zusammensetzung organischer Proben wesentlich einfacher als bei anorganischen Stoffen, da erstere nur aus sehr wenigen Elementen bestehen. Die große Mehrzahl der organischen Moleküle ist aus Kohlenstoff-, Wasserstoff-, Sauerstoff- und Stickstoffatomen. Nur wenige Moleküle enthalten noch weitere Heteroatome wie Schwefel- oder Halogenatome, die man in einfachen Tests vorab nachweisen kann.
Bei der vollständigen Verbrennung organischer Verbindungen der allgemeinen Summenformel entstehen immer Kohlenstoffdioxid und Wasser. Auf der Basis dieser Erkenntnis entwickelte J. von LIEBIG (1803-1873) bereits 1831 das Prinzip der quantitativen organischen Elementaranalyse, das im Wesentlichen auch heute noch genutzt wird.
Zur CHN-Analyse verbrennt man eine genau abgewogene Menge Substanz im Sauerstoffstrom an glühendem Kupfer(II)-oxid als Katalysator. Dabei geht Kohlenstoff in Kohlenstoffdioxid und Wasserstoff in Wasser über. Wasser wird zuerst an Calciumchlorid und Kohlenstoffdioxid in einem zweiten Absorptionsgefäß an Natronkalk, einem Gemisch aus Natrium- und Calciumhydroxid, gebunden. Die Absorption der Gase führt zu einer Massezunahme aus der man auf klassische Weise die Stoffmengen der gebildeten Oxide ermitteln kann.
Der Stickstoffanteil wird mit der gleichen Methode bestimmt. Bei der Verbrennung bilden sich Distickstoff und unterschiedliche Mengen an Stickstoffoxiden. Um auch diese zu molekularem Stickstoff zu reduzieren, werden sie an glühendem Kupfer reduziert, das gleichzeitig den überschüssigen Sauerstoff aus dem Gasgemisch absorbiert. Die Stoffmenge an entstandem Stickstoff kann nun volumetrisch bestimmt werden. Bei der Verbrennung im Sauerstoffüberschuss (a >> b) läuft formal folgende Bruttoreaktion ab:
In modernen CHN-Analysatoren werden die Mengen der gebildeten Gase nicht mehr nacheinander gravimetrisch oder volumetrisch, sondern gleichzeitig gaschromatografisch bestimmt. Dadurch und durch Auswertung der Analysenergebnisse am Computer ist die moderne CHN-Analyse, schnell, genau und und leicht automatisierbar. Zur Ermittlung der Zusammensetzung auf diese Weise benötigt man nur 2 mg Substanz! Allerdings muss die Stoffprobe auf 4 Kommastellen also auf genau eingewogen werden.
Auch bei der modernen Methode erfolgt die Berechnung der Verhältnisformel der analysierten Verbindung nach der gleichen Schrittfolge (Rechenbeispiel):
- Zusammenfassen der experimentell bestimmten Größen (Massen, Volumina, Temperatur und Druck) als gegebene Größen
- Berechnen der Stoffmengen und Massen an Kohlenstoff, Wasserstoff und Stickstoff aus den gegebenen Größen
- Ermitteln der Masse an Sauerstoff aus der Differenz zur Einwaage und Berechnung der Stoffmenge Sauerstoff
- Division aller berechneten Stoffmengen durch die kleinste experimentell bestimmte Stoffmenge und Bildung des kleinsten gemeinsamen Vielfachen
- Rundung auf natürliche ganze Zahlen
Das setzt aber voraus, dass die Verbindung keine Halogene und keinen Schwefel enthält. Wenn diese Elemente in der Verbindung enthalten sind, muss man deren Gehalte zunächst ermitteln und bei der Berechnung des Sauerstoffanteils als Differenz mit berücksichtigen.
Auf diese Weise erhält man die Koeffizienten w, x, y und z als natürliche Zahlen und stellt die Verhältnisformel auf. Diese ist oft nicht identisch mit der Summenformel, da bei größeren Molekülen die Anzahl der Atome zwei- oder dreimal so groß sein kann. Deshalb benötigt man zur Identifizierung noch die molare Masse der Verbindung und Informationen zu den funktionellen Gruppen. In modernen Laboratorien erhält man diese Informationen aus massenspektrometrischen Untersuchungen. JUSTUS von LIEBIG und seine Zeitgenossen waren dagegen noch auf die Ergebnisse der klassischen Molmassebestimmungen und der wenig spezifischen Nachweisreaktionen der funktionellen Gruppen angewiesen.
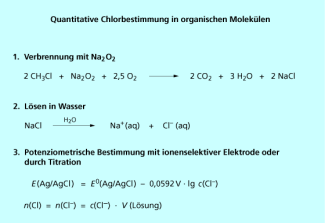
Schwefel- und halogenhaltige Substanzen werden zusätzlichen Bestimmungen unterzogen. Schwefelhaltige Substanzen werden auf aschefreiem Filterpapier an einem Platinnetz in einem sauerstoffgefülltem Kolben verbrannt. Die Verbrennungsgase werden in einer 3 %igen Wasserstoffperoxidlösung absorbiert. Die entstandene Schwefelsäure wird dann mit Lauge titriert.
Halogenhaltige Verbindungen erkennt man qualitativ an der Beilstein-Probe. Zur quantitativen Bestimmung wird die halogenhaltige Substanz in einem drucksicheren Gefäß (Nickelbombe) mit Ethylenglykol und Natriumperoxid verbrannt. Dabei werden die Halogenatome in die entsprechenden Halogenid-Ionen (Ausnahme Iodat-Ionen) überführt und können in Wasser gelöst werden. In den wässrigen Lösungen bestimmt man Fluorid, Chlorid oder Bromid potenziometrisch mit geeigneten ionensensitiven Elektroden. Die Iodat-Konzentration ermittelt man durch iodometrische Titration und berechnet daraus die Stoffmenge Iod in der eingewogenen Analysensubstanz.
Die Verhältnisformel der schwefel- und halogenhaltigen Verbindungen wird auf die gleiche Weise aus den Stoffmengen aller im Molekül enthaltenen Atome bestimmt wie bei der normalen CHN-Analyse.