Reaktionsgeschwindigkeit
Zu einer chemischen Reaktion kommt es, wenn Teilchen der Ausgangsstoffe wirksam zusammenstoßen. Je schneller sich die Konzentration der reagierenden Ausgangsstoffe ändert, umso höher ist die Geschwindigkeit einer chemischen Reaktion.
Ein Maß für die Reaktionsgeschwindigkeit ist die Änderung der Konzentration der reagierenden Ausgangsstoffe in einer bestimmten Zeit.
Die Reaktionsgeschwindigkeit ist von der Temperatur und der Konzentration der Ausgangsstoffe abhängig. Sie wächst sowohl mit steigender Temperatur als auch mit steigender Konzentration der Ausgangsstoffe.
Eine chemische Reaktion kommt zustande, wenn Teilchen der Ausgangsstoffe wirksam zusammenstoßen. Vor Beginn der chemischen Reaktion existieren nur Teilchen der Ausgangsstoffe. Deshalb gibt es häufig Zusammenstöße, bei denen sich Teilchen der Reaktionsprodukte bilden. Die Konzentration der Ausgangsstoffe nimmt demzufolge ab und die der Reaktionsprodukte zu.
Mit zunehmender Zeit verringert sich die Konzentration der Ausgangsstoffe, sodass die Wahrscheinlichkeit wirksamer Zusammenstöße der Teilchen immer geringer wird. Die Konzentration der Ausgangsstoffe sinkt weiter, aber wesentlich langsamer. Die Konzentration der Reaktionsprodukte steigt weiter, aber ebenfalls langsamer als zu Beginn der chemischen Reaktion.
Der Zeitraum in dem verschiedene Reaktanten vom Ausgangszustand in den Endzustand übergehen, d. h. das chemische Gleichgewicht erreichen, ist sehr verschieden. Zu den schnellen Reaktionen zählen vor allem die Ionenreaktionen.
Die Änderung der Konzentration der reagierenden Stoffe in einer bestimmten Zeiteinheit ist ein Maß für die Geschwindigkeit, mit der eine chemische Reaktion verläuft.
Je schneller oder langsamer sich die Konzentration der reagierenden Stoffe ändert, umso höher oder geringer ist die Reaktionsgeschwindigkeit.
![]()
Abhängigkeit der Reaktionsgeschwindigkeit von der Temperatur
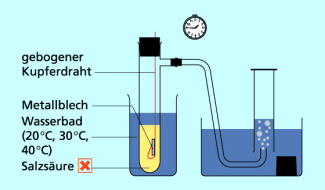
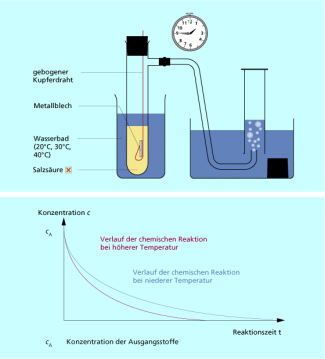
In einer Apparatur wird ein Stück Zinkblech mit Salzsäure zur Reaktion gebracht und das entstehende Wasserstoffgas pneumatisch aufgefangen. In dieser Weise werden drei Experimente durchgeführt. Die drei Zinkbleche sind gleich groß und gleich stark, die Salzsäure, von der immer das gleiche Volumen verwendet wird, hat jeweils die gleiche Konzentration. Beim ersten Experiment hat das Wasserbad eine Temperatur von 20 °C, beim zweiten von 30 °C und beim dritten von 40 °C.
-
Experiment zur Abhängigkeit der Reaktionsgeschwindigkeit von der Temperatur
Bei höherer Temperatur verfügen die Teilchen der reagierenden Stoffe über eine höhere Energie. Sie bewegen sich schneller und stoßen häufiger und mit größerer Wirksamkeit aneinander. Die Konzentration der Ausgangsstoffe nimmt schneller ab, die der Reaktionsprodukte schneller zu als bei niedriger Temperatur.
Die Reaktionsgeschwindigkeit ist von der Temperatur abhängig. Sie nimmt mit steigender Temperatur zu.
-
Reaktionsverlauf in Abhängigkeit von der Temperatur
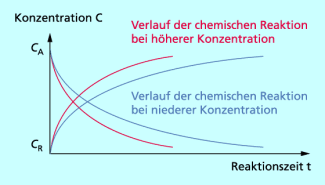
Abhängigkeit der Reaktionsgeschwindigkeit von der Konzentration
In einer Apparatur werden drei Experimente bei Zimmertemperatur durchgeführt.
Die drei Zinkbleche sind gleich groß und gleich stark. Von der Salzsäure wird immer das gleiche Volumen verwendet. Beim zweiten Experiment ist die Konzentration der Säure aber doppelt so groß (2 M) wie beim ersten, beim dritten Experiment ist sie dann dreimal (3 M) so groß.
-
Experiment der Abhängigkeit der Reaktionsgeschwindigkeit von der Konzentration
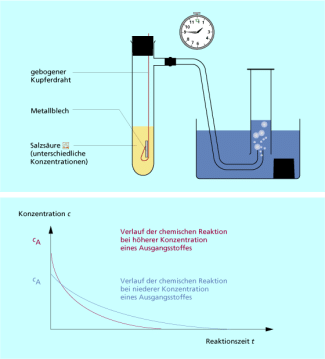
Bei höherer Konzentration sind im gleichen Volumen mehr Teilchen der Ausgangsstoffe vorhanden als bei geringerer Konzentration.
Dadurch stoßen die Teilchen öfter wirksam aneinander. Die Konzentration der Ausgangsstoffe nimmt schneller ab, die der Reaktionsprodukte schneller zu.
Die Reaktionsgeschwindigkeit ist von der Konzentration der Ausgangsstoffe abhängig. Je höher oder niedriger die Konzentration der Ausgangsstoffe ist, umso höher oder niedriger ist die Geschwindigkeit der chemischen Reaktion.
Die Reaktionsgeschwindigkeit einer chemischen Reaktion wird außer von der Temperatur und der Konzentration der beteiligten Stoffe von der Oberfläche der reagierenden Stoffe und der Anwesenheit von Katalysatoren beeinflusst. Die Lehre vom zeitlichen Ablauf chemischer Reaktionen wird als Chemische Kinetik bezeichnet.
-
Reaktionsverlauf in Abhängigkeit von der Konzentration