RGT-Regel
Je höher die Temperatur ist, desto schneller verlaufen chemische Reaktionen. Die RGT-Regel ist eine Faustregel, die für fast alle chemischen und physiologischen Reaktionen anwendbar ist. Sie besagt, dass sich bei einer Temperaturerhöhung um 10 K die Reaktionsgeschwindigkeit verdoppelt bis vervierfacht. Die Stoßtheorie beschreibt die Gründe dieser Regel.
Die Reaktionsgeschwindigkeit-Temperatur-Regel wurde um 1885 von JACOBUS HENRICUS VAN ’T HOFF aufgestellt. Er lebte von 1852 bis 1911 und erhielt 1901 den ersten Nobelpreis für Chemie.
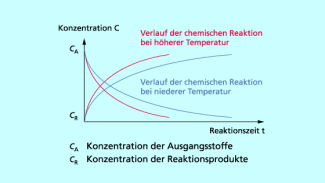
Diese Regel beschreibt einen Zusammenhang zwischen der Reaktionsgeschwindigkeit und der Temperatur. Zwischen ihnen besteht eine exponentielle Abhängigkeit: Mit steigender Temperatur nimmt auch die Geschwindigkeit der Reaktion stark zu.
Für viele chemische und physiologische Reaktionen gilt diese Faustregel.
RGT-Regel
Die RGT-Regel besagt, dass sich die Reaktionsgeschwindigkeit einer chemischen Reaktion bei einer Temperaturerhöhung um 10 K (Kelvin) verdoppelt bis vervierfacht.
Der Faktor ist aber nur ein Durchschnittswert. Bei einigen Reaktionen muss sich die Temperatur um 20 bis 30 K erhöhen, damit sich die Geschwindigkeit verdoppelt, bei anderen Reaktionen reicht eine Temperaturerhöhung von 5 K. Bei anderen Reaktionen nimmt die Geschwindigkeit mit steigender Temperatur ab. Es sind also auch viele Ausnahmen bekannt. Die RGT-Regel gilt bei vielen Prozessen nur im mittleren Temperaturbereich.
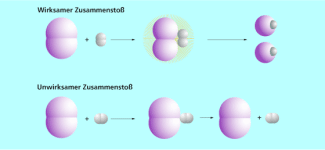
Die Stoßtheorie
Die Stoßtheorie erklärt die Arten der Zusammenstöße.
Man unterscheidet zwischen dem unwirksamen (elastischen) und dem wirksamen (unelastischen) Zusammenstoß, wobei der unwirksame Zusammenstoß zu keiner Reaktion führt, da die Teilchen nach dem Zusammenprall wieder auseinandergehen. Für das wirksame Zusammentreffen von Teilchen müssen einige Bedingungen erfüllt werden.
Die Teilchen müssen eine günstige räumliche Lage zueinander haben, das bedeutet, dass die reaktiven Zentren beim Stoß zusammentreffen müssen.
Außerdem ist eine bestimmte Mindestenergie der Teilchen erforderlich. Sie muss beim Ablauf einer Reaktion für das Auflockern und Lösen der bestehenden Bindungen in den Ausgangsstoffen und zur Bildung neuer chemischer Bindungen aufgewendet werden. Man nennt diese Energie die Aktivierungsenergie. Sie wird bei zusammenstoßenden Teilchen von der kinetischen Energie aufgebracht. Die Energie der Teilchen muss also größer sein als die Aktivierungsenergie.
Die Teilchen besitzen bei einer gegebenen Temperatur nicht alle die gleiche kinetische Energie, sondern weisen eine Energieverteilung auf. Diese ist temperaturabhängig. Je höher die Temperatur, desto höher ist der Anteil der Teilchen mit einer kinetischen Energie oberhalb der Mindestenergie. Damit kommt es bei höheren Temperaturen zu mehr wirksamen Zusammenstößen.
Die Reaktionsgeschwindigkeit kann durch weitere Faktoren beeinflusst werden :
- Konzentration der Ausgangsstoffe (Anzahl der Teilchen pro Volumen),
- Druck und
- Vorhandensein von Katalysatoren.
-
Reaktionsverlauf in Abhängigkeit von der Temperatur
-
Eine Elementarreaktion erfolgt immer durch das Zusammenstoßen von Teilchen.