Vielfalt organischer Stoffe
Die Gruppe der anorganischen Stoffe besteht aus etwa hunderttausend unterschiedlichen chemischen Verbindungen, die die verschiedenen Elemente des Periodensystems enthalten. Im Gegensatz dazu gibt es mehrere Millionen organische Stoffe. Die Zahl ist verblüffend, da sich die organischen Verbindungen zum größten Teil nur aus 5 bis 6 Elementen (Kohlenstoff und Wasserstoff, häufig noch Sauerstoff, Stickstoff, Phosphor und Schwefel) zusammensetzen.
Der Begriff Organische Chemie wurde von BERZELIUS eingeführt und umfasste die Verbindungen, die von Organismen (z. B. Pflanzen) synthetisiert wurden. Man glaubte, dass dazu eine besondere Kraft, die „vis vitalis“ erforderlich sei. Nachdem es WÖHLER 1828 gelungen war, die anorganische Verbindung Ammoniumcyanat in die organische Verbindung Harnstoff umzuwandeln, setzte sich dann aber die Meinung durch, dass man organische Verbindungen auch im Labor ohne vis vitalis herstellen kann.
Organische Stoffe werden von Lebewesen im Stoffwechsel gebildet, aber auch industriell hergestellt. Sie enthalten immer das Element Kohlenstoff, fast alle auch Wasserstoff. Nur wenige weitere der über hundert Elemente des Periodensystems, wie Sauerstoff, Stickstoff, Schwefel oder Phosphor, sind insgesamt am Aufbau organischer Verbindungen beteiligt. Heute kennt man mehrere Millionen dieser organischen Stoffe und durch Industrie und Forschung werden jährlich Zehntausende neue synthetisiert. Dieser riesigen Anzahl stehen nur etwa Hunderttausend anorganische Stoffe gegenüber.
Wenn man den großen Anteil von Wasser einmal nicht einbezieht, besteht ein Mensch fast nur aus organischen Molekülen. Die Eiweiße, die am Aufbau jeder Zelle beteiligt sind, gehören zu den Grundbausteinen jedes auf der Erden vorkommenden Lebewesens. Auch Kohlenhydrate und Fette haben ihren Anteil an den „Baustoffen“ des Körpers.
In der Natur findet man sowohl sehr einfach gebaute organische Stoffe wie Methan, welches in Erdgas vorkommt und dessen Moleküle nur aus einem Atom des Elements Kohlenstoff und vier Atomen des Elements Wasserstoff bestehen.
Kompliziertere Moleküle weist Traubenzucker mit insgesamt 24 Atomen (Kohlenstoff, Wasserstoff und Sauerstoff) auf. Es gibt aber auch Riesen unter den organischen Stoffen, zum Beispiel Stärke oder Eiweiße, in deren Makromolekülen Tausende Atome miteinander verknüpft sind.
Schon seit dem Beginn des 20. Jahrhunderts kann eine Vielzahl von organischen Stoffen auch industriell hergestellt werden, darunter solche, die gar keine Entsprechung in der Natur haben. Daher wächst die Zahl der organischen Verbindungen jährlich.
Seit vielen Jahrzehnten nutzen wir so zum Beispiel Kunststoffe oder Kunstfasern. Zuerst versuchte man, Stoffe künstlich herzustellen, die den Naturstoffen entsprechen und anstelle dieser Naturstoffe eingesetzt werden können. Heute produziert man Stoffe maßgeschneidert. Die Eigenschaften sind genau auf den Einsatz abgestimmt.
| Organische Stoffe | ||
| In der Natur vorkommend | ||
| Beispiel | Vorkommen | Stoffgruppe |
| Methan | Erdgas, Grubengas, Wiederkäuermagen | Alkane |
| Ethen | Reifeprozesse bei Früchten | Alkene |
| Ethanol | „Trinkalkohol“, durch alkoholische Gärung von Früchten | Alkanol |
| Ethansäure | Haushaltsessig, durch Essigsäuregärung | Alkansäure |
| Glucose (Traubenzucker) | in Früchten | Kohlenhydrate |
| Cellulose | Zellstoff für Taschentücher oder Verbandsmaterial, in Holz, Zellwände pflanzlicher Zellen | Kohlenhydrate |
| Kokosfett | in Kokosnüssen | Stoffgemisch verschiedener Fette |
| Olivenöl | Oliven | Stoffgemisch verschiedener Fette |
| Casein | in Kuhmilch | Eiweiße |
| Industriell hergestellt | ||
| Polystyren (Polystyrol) | Verpackungsmaterial („Quietschpappe“) | Plast |
| Gummi | Autoreifen | Elast |
| Polyamid | Kleidung | Kunstfaser |
| FCKW | Treibgase, Kühlmittel, Narkosemittel (Verwendung in Deutschland mehr und mehr eingeschränkt) | halogenierte Kohlenwasserstoffe |
| Ascorbinsäure | industriell hergestelltes Vitamin C | Säure |
| Aspirin | Medikament (Schmerzmittel) | Ester |
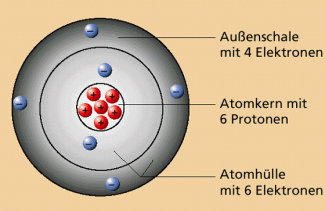
Kohlenstoffatome bilden das „Rückgrat“ aller organischen Stoffe. Das Kohlenstoffatom weist vier Außenelektronen auf. Um eine mit acht Elektronen besetzte Außenschale (Elektronenoktett bzw. Edelgaskonfiguration) und damit Stabilität zu erreichen, benötigt ein Kohlenstoffatom zusätzlich zu seinen vier Außenelektronen noch vier weitere Elektronen. Diese werden durch die Ausbildung gemeinsamer Elektronenpaare mit anderen Atomen gewonnen.
Kohlenstoffatome können demzufolge vier gemeinsame Elektronenpaare mit anderen Atomen ausbilden. Es hat, symbolisch gesehen, „vier Arme, welche es ausstrecken kann, um damit anderen Atomen die Hand zu reichen“.
-
Modell eines Kohlenstoffatoms.
Die gemeinsamen Elektronenpaare können mit anderen Kohlenstoffatomen oder auch mit Wasserstoffatomen oder Sauerstoffatomen o. a. ausgebildet werden.
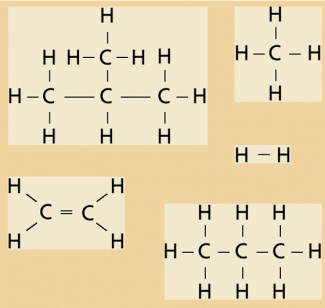
Die enorme Vielfalt der organischen Verbindungen kommt nun dadurch zustande, dass sich die Kohlenstoffatome durch die Ausbildung gemeinsamer Elektronenpaare miteinander zu kettenförmigen, zu verzweigten oder auch zu ringförmigen Molekülen verbinden können.
Die noch frei bleibenden Außenelektronen („Bindungsarme“) können mit unterschiedlichen Atomen Bindungen eingehen. So lassen sich schon aus wenigen Kohlenstoffatomen und einer unterschiedlichen Anzahl von Wasserstoffatomen viele verschiedene Moleküle konstruieren.
-
Durch die Ausbildung gemeinsamer Elektronenpaare erreichen alle Kohlenstoffatome und alle Wasserstoffatome die Edelgaskonfiguration.
-
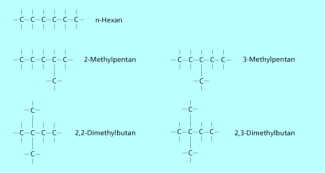
Isomere von Hexan C6H14