vierte Hauptgruppe
Zur vierten Hauptgruppe gehören die Elemente Kohlenstoff, Silicium, Germanium, Zinn und Blei.
Der Metallcharakter der Elemente nimmt mit steigender Ordnungszahl zu. Kohlenstoff ist ein typisches Nichtmetall, Germanium ein typisches Halbmetall, Blei ein typisches Metall.
Kohlenstoff besitzt von allen Elementen die ausgeprägteste Tendenz zur Bildung von Ketten und Ringen und bildet zahlreiche Verbindungen mit C-C - oder C-Element-Mehrfachbindungen. Daraus resultiert eine Vielzahl von Verbindungen, die die Grundlage für das Leben auf der Erde bilden und Thema der organischen Chemie sind.
Gruppeneigenschaften
Die Elemente der 4. Hauptgruppe sind Kohlenstoff (C), Silicium (Si), Germanium (Ge), Zinn (Sn) und Blei (Pb).
In dieser Hauptgruppe ist der Übergang vom Nichtmetall (Kohlenstoff) zu den Metallen (Zinn, Blei) besonders deutlich zu sehen.
Die Elemente der 4. Hauptgruppe besitzen vier Außenelektronen, d. h. sie müssten vier Elektronen aufnehmen oder abgeben, um Edelgaskonfiguration mit acht Elektronen zu erreichen.
Weil es sehr viel Energie erfordert, vier Elektronen aufzunehmen oder abzugeben, bilden insbesondere Kohlenstoff und Silicium vier Atombindungen aus, um auf diese Weise zur Edelgaskonfiguration zu gelangen. Bei den schwereren Elementen sind die Außenelektronen weiter vom Kern entfernt und werden daher von ihm nicht so stark angezogen, weshalb Zinn und Blei ihre Außenelektronen abgeben können und typische Ionenverbindungen bilden. Dies zeigt sich daran, dass die Elemente der 4. Hauptgruppe mit steigender Ordnungszahl zunehmend besser mit Sauerstoff und den Halogenen reagieren.
Kohlenstoff hat wie kein anderes Element die Fähigkeit, Ketten und Ringe zu bilden, wobei eine Vielzahl von Verbindungen gebildet wird, deren Untersuchung Aufgabe der organischen Chemie ist. Diese Eigenschaft und die Möglichkeit zur Ausbildung von Mehrfachbindungen ist bei den schwereren Elementen der 4. Hauptgruppe nicht vorhanden. Zwar gibt es Verbindungen mit Si=Si-Bindungen, aber diese sind wesentlich instabiler als die entsprechenden Kohlenstoffverbindungen.
Eigenschaften und Verwendung
Die wichtigsten Kohlenstoffmodifikationen sind Grafit und Diamant.
Grafit ist ein schwarzer, weicher, fettig glänzender Feststoff, der Wärme und elektrischen Strom leitet. Diese Eigenschaften lassen sich durch die Bindungsverhältnisse erklären. Beim Grafit ist jedes Kohlenstoffatom an nur drei andere gebunden, wodurch Schichten entstehen, in denen Sechsringe aus Kohlenstoffatomen bienenwabenartig angeordnet sind. Weil pro Atom nur drei Bindungen gebildet werden, verbleibt an jedem Kohlenstoffatom ein freies Elektron. Diese Elektronen sind innerhalb der Schichten frei beweglich und verbinden die Schichten locker miteinander. Diese Art der Bindung liefert eine Erklärung für die Eigenschaften von Grafit.
Weil ein Teil der Elektronen frei beweglich ist, weist Grafit parallel zu den Schichten eine gute elektrische Leitfähigkeit auf und wird als Elektrodenmaterial verwendet.
Da die Schichten, aus denen Grafit besteht, nicht fest miteinander verbunden sind, sind sie leicht gegeneinander zu verschieben. Daraus resultiert die Verwendung von Grafit als hochtemperaturfestes Schmiermittel. Weil die Schichten außerdem leicht abgerieben werden, wurde Grafit in Bleistiften verwendet, die daher richtiger „Grafitstifte“ heißen müssten.
Grafit kommt auch in anderen Formen vor, in denen die Schichten nicht so regelmäßig angeordnet sind. Eine dieser Formen ist Ruß , der bei der Verbrennung von Kohlenwasserstoffen entsteht.
Ruß wird insbesondere in der Autoreifenindustrie als Füllstoff verwendet, außerdem ist er ein wichtiges Schwarzpigment in Farben und Lacken.
Eine weitere Form von Grafit ist Aktivkohle , die aus feinen Grafitkristallen besteht und eine große spezifische Oberfläche aufweist. Aufgrund ihres hohen Absorptionsvermögens wird sie in Gasmasken eingesetzt und zur Entfernung von Verunreinigungen aus Lösungen verwendet, beispielsweise in der Wasseraufbereitung oder zur Entfärbung von Rohrzuckerlösungen.
-
Grafit ist eine Modifikation des Kohlenstoffs.

cevahir87 - adobe stock
Diamant ist ein durchsichtiger, glänzender Feststoff, er leitet den elektrischen Strom nicht. Außerdem ist er der härteste natürlich vorkommende Stoff auf der Erde. Seine Eigenschaften unterscheiden sich also deutlich von denen des Grafits, was sich ebenfalls durch die Bindungsverhältnisse erklären lässt.
Jedes Kohlenstoffatom ist über Atombindungen mit vier weiteren Kohlenstoffatomen verbunden. Auf diese Weise entstehen als Struktureinheit Tetraeder aus jeweils fünf Kohlenstoffatomen, die voneinander gleich weit entfernt sind. Aus vielen solchen Tetraedereinheiten entsteht eine sehr stabile regelmäßige Anordnung, das Diamantgitter.
Die Atombindungen zwischen den Kohlenstoffatomen sind sehr stark, weshalb Diamant der härteste natürlich vorkommende Stoff ist. Weil es im Gitter keine freien Elektronen gibt, leitet Diamant den elektrischen Strom nicht.
Verwendet wird Diamant hauptsächlich als Schleifmittel, in Bohrköpfen und zum Schneiden von Glas. Größere Diamantkristalle sind wertvolle Edelsteine. Werden sie mit besonderen Schliffflächen versehen, so entstehen Brillanten.
Diamant lässt sich bei sehr hohem Druck und hohen Temperaturen aus Grafit gewinnen.
Auf diesem Wege werden pro Jahr mehr als 20 t Industriediamanten gewonnen, die für die oben genannten technischen Anwendungen eingesetzt werden. Die Herstellung von größeren Diamanten, die als Schmucksteine geeignet sind, ist so teuer, dass sie sich nicht lohnt.
-
Diamant ist eine Modifikation des Kohlenstoffs.

supachai sumrubsuk - shutterstock
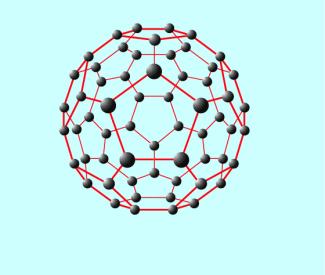
1991 wurden die Fullerene entdeckt, eine weitere Modifikation des Kohlenstoffes, bei denen die C-Atome in Fünf- und Sechsringen kugelförmig als Moleküle („Fußbälle“) vorliegen.
Kohlenstoff ist als Grafit reaktionsträge und als Diamant noch mehr. Er reagiert erst bei hohen Temperaturen mit Wasserstoff, mit Sauerstoff oder Wasserdampf. Direkt reagiert er bei Raumtemperatur nur mit dem äußerst reaktiven Fluor.
-
Die Fullerene sind eine weitere Modifikation des Kohlenstoffs, sie wurden im Jahr 1991 entdeckt.
Silicium ist ein dunkelgrauer, glänzender, harter und spröder Feststoff. Sein Aufbau entspricht dem von Diamant, bei Zimmertemperatur gibt es also keine frei beweglichen Elektronen und somit keine elektrische Leitfähigkeit. Bei höheren Temperaturen lösen sich allerdings immer mehr Elektronen aus den Atombindungen und werden frei beweglich, sodass Silicium ein Halbleiter ist.
Auch Silicium ist wenig reaktiv, es reagiert nur bei hohen Temperaturen mit Stickstoff, Kohlenstoff, Schwefel und Metallen. Mit Fluor oder warmer Natronlauge reagiert Silicium spontan.
Mit Säuren außer Fluss-Säure (HF) reagiert Silicium praktisch nicht, da sich eine unlösliche Schicht aus Siliciumdioxid bildet, die verhindert, dass das darunterliegende Silicium angegriffen wird. Aufgrund dieser Passivierung verbrennt Silicium auch an der Luft erst bei Temperaturen von über 1 000 °C, denn erst unter diesen Bedingungen wird die Oxid-Schutzschicht zerstört, und das darunterliegende Silicium kann reagieren.
Hochreines Silicium und dotiertes Silicium, bei dem z. B. Arsen- oder Galliumatome ins Gitter eingebaut sind, spielen aufgrund ihrer Halbleitereigenschaften eine wichtige Rolle in der Mikroelektronik, beispielsweise beim Computerbau.
Germanium ist ein grauweißer, sehr spröder Feststoff, der als Halbleiter elektrische Leitfähigkeit aufweist. Chemisch gesehen ist es in seinen Eigenschaften dem Silicium sehr ähnlich, und ebenso wie dieses wird es als Halbleiter verwendet.
Von Zinn gibt es eine metallische und eine nichtmetallische Modifikation. Das metallische beta-Zinn ist bei Temperaturen oberhalb von 13 °C die stabilere Modifikation und wandelt sich unterhalb dieser Temperatur – allerdings sehr langsam – in das pulvrige halbmetallische alpha-Zinn um. Wird metallisches Zinn über längere Zeit zu kalt gelagert, so bilden sich Kristallkeime von alpha-Zinn, von denen aus die Umwandlung schneller voranschreitet, weshalb dieses Phänomen auch als „Zinnpest“ bezeichnet wird.
Verwendet wird Zinn schon seit langer Zeit. Von großer Bedeutung ist Bronze , eine Zinn-Kupfer-Legierung, die seit ca. 3 500 v. Chr. verwendet wird. Auch heute spielt Zinn als Legierungsbestandteil eine wichtige Rolle. Außerdem wird Eisenblech verzinnt, um es vor Korrosion zu schützen (Weißblech).
Blei ist ein blaugraues, weiches Schwermetall. Frische Schnittflächen sind glänzend, werden aber schnell matt, weil eine dünne Schicht von Bleioxid gebildet wird. Dies führt zur Passivierung, d. h. die weitere Oxidation wird verhindert. Auch gegen Schwefel-, Salz- und Fluorwasserstoffsäure (Fluss-Säure) ist Blei widerstandsfähig, weil die entsprechenden Salze schwer lösliche, gut haftende Schichten bilden.
Von Wasser, das Sauerstoff oder Kohlenstoffdioxid enthält, wird Blei hingegen mit der Zeit aufgelöst, weil lösliches Blei(II)-hydroxid und Blei(II)-hydrogencarbonat gebildet werden.
Da die entstehenden Pb(II)-Ionen toxisch sind, dürfen Trinkwasserleitungen nicht mehr aus Blei hergestellt werden.
Verwendung findet Blei als Legierungsmaterial und zur Herstellung von Akkumulatoren.
Vorkommen und Gewinnung
Kohlenstoff kommt in der Natur elementar in den beiden Modifikationen Grafit und Diamant vor. Die Hauptmenge findet sich jedoch in gebundener Form, hauptsächlich als Calciumcarbonat in Kalkstein, Marmor und Kreide, als Magnesium-Calcium-Carbonat (Dolomit), als Magnesiumcarbonat (Magnesit) und als Eisencarbonat (Siderit).
Kohlenstoff kommt in gebundener Form außerdem in allen Organismen vor – alles Leben auf der Erde basiert auf Kohlenstoffverbindungen. In geringer Menge (0,04 %) ist Kohlenstoffdioxid in der Atmosphäre vorhanden.
Reiner Kohlenstoff lässt sich durch thermische Zersetzung von Kohle, Erdöl oder Erdgas gewinnen.
Silicium kommt in der Natur als Oxid (Sand, Quarz) und in Form der vielfältig strukturierten Silicate vor. Es ist nach Sauerstoff das zweithäufigste Element in der Erdkruste.
Hochreines Silicium, das für die Halbleitertechnik benötigt wird, wird in mehreren Schritten aus Siliciumdioxid hergestellt.
| 1. | Aus Siliciumdioxid lässt sich durch Reduktion mit Kohlenstoff Rohsilicium gewinnen. |
| 2. | Dieses wird mit HCl in Trichlorsilan überführt, das durch Destillation gereinigt wird. Die Gehalte von störenden Begleitelementen im Rohsilicium liegen z. B. für Aluminium und Eisen im Zehntel-Prozent-Bereich, bei anderen wie Phosphor zwischen 0,001 % und 0,01 %. Bei der Chlorierung werden alle Elemente in ihre Chloride überführt. Der Siedepunkt des Trichlorsilans von 32 °C liegt weit unter den Siedepunkten der Chloride der störenden Begleitelemente im Rohsilicium (Siedepunkte z. B. PCl3 : 74 °C ; AlCl3 : 183 °C ; FeCl3 : 316 °C). Somit kann man durch Destillation Trichlorsilan leicht von den anderen Chloriden abtrennen und daraus dann hochreines Silicium gewinnen. |
| 3. | Die Reduktion mit Wasserstoff liefert dann Reinsilicium. |
| 4. | Reinsilicium wird mit weiteren Reinigungsverfahren (z. B. Zonenschmelzen) in Reinstsilicium überführt. |
Das seltene Germanium kommt nur in wenigen Mineralien angereichert vor. Enthalten ist Germanium z. B. im Argyrodit (), in dem es 1886 von CLEMENS WINKLER entdeckt wurde. Als Ausgangsmaterial für die Gewinnung von elementarem Germanium wird Germanit verwendet. Die Herstellung von Germanium verläuft ebenfalls über mehrere Stufen. Germanium ist wie Silicium ein Halbleiter und wurde früher für elektronische Bauelemente verwendet. Bei etwas höherer Temperatur verschlechtern sich aber die Eigenschaften der Bauelemente infolge der zunehmenden Leitfähigkeit des Germaniums. Das ist bei Silicium nicht in dem Umfang der Fall, sodass Germanium nur noch für spezielle Anwendungen eingesetzt wird.
Zinn kommt überwiegend als Oxid (Zinnstein) vor.
Elementares Zinn wird durch Reduktion von Zinnstein mit Kohlenstoff gewonnen.
Außerdem lässt sich Zinn elektrolytisch beim Recycling von verzinntem Eisenblech (Weißblech) gewinnen.
Blei kommt in der Natur hauptsächlich als Sulfid PbS (Bleiglanz) vor. Zur Gewinnung von elementarem Blei wird Bleiglanz geröstet und in das Oxid überführt. Aus dem Oxid wird durch Reduktion mit Kohlenstoff Blei gewonnen.
Wichtige Verbindungen
Wichtige anorganische Verbindungen des Kohlenstoffs
Die beiden Oxide des Kohlenstoffs, Kohlenstoffmonooxid und Kohlenstoffdioxid, sind gasförmig. Sie sind Molekülverbindungen: In beiden Oxiden bestehen polare Atombindungen zwischen Sauerstoff- und Kohlenstoffatomen.
Kohlenstoffmonooxid CO entsteht bei der unvollständigen Verbrennung von Kohlenstoff (z. B. bei Schwelbränden). An der Luft verbrennt es mit typischer blauer Flamme zu Kohlenstoffdioxid. Weil es selbst leicht oxidierbar ist, wird es als Reduktionsmittel beispielsweise im Hochofenprozess zur Eisengewinnung verwendet.
Kohlenstoffmonooxid ist für den Menschen hochgiftig, weil es beim Einatmen eine feste Bindung mit Hämoglobin eingeht, das Sauerstoff im Blut transportiert. Hämoglobin wird auf diese Weise blockiert und somit der Sauerstofftransport im Blut verhindert.
Kohlenstoffdioxid entsteht bei der vollständigen Verbrennung von Kohlenstoff. Es ist ein sehr reaktionsträges Gas, das nicht brennt und die Verbrennung nicht unterhält. Es wird daher in Feuerlöschern verwendet.
Festes Kohlenstoffdioxid wird auch „Trockeneis“ genannt, es sublimiert bei -78 °C und wird als Kältemittel verwendet.
Kohlenstoffdioxid löst sich bei erhöhtem Druck in Wasser, wobei eine schwach saure Lösung entsteht, die Kohlensäure. Nur ein geringer Teil des gelösten Kohlenstoffdioxids reagiert mit Wasser:
Die Kohlensäure ist nicht isolierbar, weil sie sich beim Entwässern in Kohlenstoffdioxid und Wasser zersetzt.
Zur Herstellung von kohlensäurehaltigen Getränken wird Kohlenstoffdioxid unter Druck in Wasser eingeleitet. Die typischen Bläschen bestehen aus ungelöstem Kohlenstoffdioxid.
Die Salze der Kohlensäure, die Carbonate , kommen zahlreich in der Natur vor und sind zum Teil industriell von Bedeutung. Wichtige Carbonate sind beispielsweise Calciumcarbonat (Kalkstein, Kreide, Marmor), Magnesiumcarbonat (Magnesit), Calcium-Magnesium-Carbonat (Dolomit) und Natriumcarbonat (Soda). Neben den Carbonaten bildet die Kohlensäure als zweiwertige Säure auch Hydrogencarbonate (MeHCO3). Das Gleichgewicht zwischen dem schwer löslichen Calciumcarbonat und dem gut löslichen Calciumhydrogencarbonat ist in Natur und Technik von Bedeutung (z. B. Tropfsteinhöhlen, Wasserhärte).
Ein wichtiges Industrieprodukt ist Calciumcarbid (Calciumacetylid), das bei 2 300 °C aus Calciumoxid und Koks synthetisiert wird.
Bei der Hydrolyse von Calciumcarbid entsteht Ethin (Acetylen), das zum autogenen Schweißen verwendet wird und als Ausgangsstoff für verschiedene organische Synthesen dient.
-
Die Bläschen im Mineralwasser bestehen aus Kohlenstoffdioxid.

Heinz Mahler, Berlin
Wichtige Verbindungen des Siliciums
Siliciumdioxid ist wie Kohlenstoffdioxid eine Molekülverbindung, bei der polare Atombindungen zwischen den Atomen vorliegen. Im Gegensatz zum gasförmigen Kohlenstoffdioxid mit Doppelbindungen zwischen Kohlenstoff und den beiden Sauerstoffatomen ist es jedoch ein harter, kristalliner Feststoff. Im Kristall ist jedes Siliciumatom tetraedrisch von vier Sauerstoffatomen umgeben. Es entsteht ein regelmäßiges Gitter, in dem Silicium- und Sauerstoffatome im Verhältnis von 1:2 vorliegen, wie die Summenformel zeigt.
Siliciumdioxid kommt in der Natur hauptsächlich als Quarz vor. Viele bekannte Schmucksteine sind Abarten von Quarz, beispielsweise Bergkristall, Amethyst, Rosenquarz und Tigerauge. Auch andere Halbedelsteine wie Carneol, Achat und Opal bestehen aus Siliciumdioxid.
Schmilzt man Siliciumdioxid und lässt die Schmelze schnell erstarren, so erhält man Quarzglas , das chemisch widerstandsfähig und hochschmelzend ist und zum Bau von Laborgeräten verwendet wird. Zur Herstellung von Gläsern für den alltäglichen Gebrauch werden der Schmelze weitere Oxide wie Natriumoxid, Calciumoxid oder Kaliumoxid zugesetzt.
Siliciumdioxid löst sich in Natronlauge unter Bildung von Silicaten. Beim Ansäuern der Lösung erhält man die zugehörige Säure, die Kieselsäure , bei der das Siliciumatom tetraedrisch von vier OH-Gruppen umgeben ist. Sie ist einige Zeit in sehr verdünnter wässriger Lösung stabil. Unter Wasserabspaltung kondensiert Kieselsäure zu Oligo- bzw. Polysilicaten. Je nach Vernetzungsgrad unterscheidet man verschiedene Silicate , z. B. Kettensilicate, zu denen u. a. Asbest gehört, Schichtsilicate wie Talk und Kaolinit (Porzellanerde) und Gerüstsilicate, z. B. Feldspate und Zeolithe. Die Struktur der dreidimensional vernetzten Kieselsäure entspricht der von Siliciumdioxid. Die unterschiedlichen Silicate stellen den Hauptbestandteil der Erdkruste dar.
Silicate sind als Baustoffe von großer Bedeutung, sie sind beispielsweise Rohstoffe zur Herstellung von Zement, Keramiken und Porzellan. Kieselgele (kondensierte Silicate) haben ein ähnlich gutes Adsorptionsvermögen wie Aktivkohle und dienen der Reinigung von Gasen und Flüssigkeiten.
-
Bergkristall besteht aus Quarz, einer Modifikation von Siliciumdioxid.

Heinz Mahler, Berlin
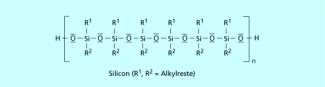
Eine wichtige Gruppe von Siliciumverbindungen sind die Silicone , die aus Silicium, Sauerstoff und Kohlenwasserstoffresten aufgebaut sind. Sie sind thermisch und chemisch beständige Kunststoffe, die eine große Bandbreite von Eigenschaften und damit von Verwendungsmöglichkeiten aufweisen. So dienen sie beispielsweise als Schmiermittel, als Dichtungsmittel und zur Imprägnierung.
-
Silicone bestehen aus Silicium, Sauerstoff und Alkyl-Resten.
Suche nach passenden Schlagwörtern
- Quarzglas
- Kohlenstoffdioxid
- Oxide
- Grafit
- Zinn
- Calciumcarbid
- Quarz
- Silicate
- Blei
- Silikate
- Marmor
- Kohlensäure
- Kieselsäure
- Fullerene
- Aktivkohle
- Silicone
- Carbonate
- Ruß
- Silicium
- Germanium
- Graphit
- Bronze
- Diamant
- Silikone
- Kohlenstoffmodifikationen
- Kohlenstoff
- Siliciumdioxid
- Kohlenstoffmonooxid
- Wasserstoffverbindungen

