Entwicklung der Vorstellungen vom Atom
Bereits in der Antike gab es Vorstellungen darüber, dass die Stoffe aus sehr kleinen Teilchen bestehen könnten. Sie wurden als Atome (atomos (griech.) = das Unteilbare) bezeichnet. Über viele Jahrhunderte spielte aber diese Idee keine Rolle. Erst im 18. und 19. Jahrhundert wurde im Zusammenhang mit der Entwicklung der Wärmelehre und der Elektrizitätslehre die Frage nach den elementaren Bausteinen der Stoffe wieder aufgegriffen. Die Frage, ob Atome nur ein Modell sind oder tatsächlich existieren, konnte aber erst in den ersten beiden Jahrzehnte des 20. Jahrhundert entschieden werden.
Erste Vorstellungen
Bereits in der Antike gab es Vorstellungen darüber, dass die Stoffe aus sehr kleinen Teilchen bestehen könnten. Sie wurden als Atome (atomos (griech.) = das Unteilbare) bezeichnet. Ein Vertreter dieser Auffassung war der griechische Philosoph DEMOKRIT (460-370 v. Chr.). Diese ursprünglichen Vorstellungen waren naturgemäß sehr vage, sie spielten in den folgenden Jahrhunderte keine Rolle.
Erst im 18. und 19. Jahrhundert begannen im Zusammenhang mit verschiedenen naturwissenschaftlichen Untersuchungen Fragen nach den elementaren Bestandteilen der Stoffe wieder eine Rolle zu spielen.
-
Modell eines Uran-Atoms
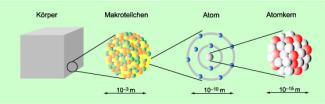
Die Atomtheorie entwickelt sich
Aus chemischer Sicht beschäftigte sich der Engländer JOHN DALTON (1766-1844, Bild 2) mit der Frage nach den elementaren Bestandteilen. DALTON hatte verschiedene Gesetze über chemische Reaktionen entdeckt, beispielsweise das Gesetz der konstanten Proportionen, das besagt: In einer chemischen Verbindung sind die Bestandteile stets in einem bestimmten Massenverhältnis enthalten. Um dieses und andere chemische Gesetze zu erklären, entwickelte DALTON 1808 eine Atomhypothese, deren Kernaussagen lauten:
- Jedes Element besteht aus kleinsten, chemisch nicht weiter zerlegbaren Teilchen, den Atomen.
- Atome eines Elements haben die gleiche Größe, die gleiche Masse und verhalten sich chemisch gleich.
- Atome verschiedener Elemente sind voneinander verschieden.
- Bei der chemischen Verbindung von zwei oder mehreren Elementen verbinden sich die Atome zu neuen Teilchen, den Molekülen.
- Die unterschiedlichen Eigenschaften der chemischen Verbindungen ergeben sich aus der Verschiedenartigkeit ihrer Zusammensetzung und der unterschiedlichen Struktur.
Diese daltonsche Atomhypothese erwies sich als außerordentlich tragfähig und trug entscheidend zur Entwicklung der Atomtheorie bei.
Durch Forschungen in unterschiedlichen Bereichen gab es im Laufe der Zeit weitere Belege für die Existenz von kleinsten Teilchen.
Der Biologe ROBERT BROWN (1773-1858) beobachtete 1827 unter dem Mikroskop eine unruhige Bewegung von Blütenstaubkörnchen. Diese Bewegung, die heute als brownsche Bewegung bezeichnet wird, kommt durch die Stöße von Atomen gegen makroskopische Teilchen zustande. Eine Erklärung dafür konnte erst 1905 durch ALBERT EINSTEIN (1879-1955) gegeben werden.
Bereits vorher hatten viele Physiker mit Katodenstrahlen experimentiert und festgestellt, dass sich diese Strahlen in elektrischen und magnetischen Feldern ablenken lassen. Der deutsche Physiker WIECHERT und der englische Physiker THOMSON fanden unabhängig voneinander, dass Katodenstrahlen aus sehr kleinen Teilchen mit negativer Ladung bestehen müssten. Für diese Teilchen wurde 1897 von FITZGERALD die Bezeichnung Elektron eingeführt.
Zwei andere bedeutende Entdeckungen führten immer stärker zu der Frage nach den elementaren Bausteinen der Stoffe: 1895 fand WILHELM CONRAD RÖNTGEN die nach ihm benannten Röntgenstrahlen .1898 entdeckten MARIE und PIERRE CURIE die Eigenschaft verschiedener Stoffe, eine bestimmte Strahlung aussenden, die wir heute als radioaktive Strahlung kennen. Beide Arten von Strahlungen kommen durch Vorgänge im atomaren Bereich zustande.
Die verschiedenen Atommodelle
Um 1900 entwickelten WILLIAM THOMSON (Lord KELVIN, 1824-1907) und JOSEPH JOHN THOMSON (1856-1940) ein Atommodell, das man mitunter auch als Rosinenmodell bezeichnet: Das kugelförmige Atom sollte aus einer positiven elektrischen Flüssigkeit bestehen, in die negativ geladene Elektronen eingebettet sind. Damit konnte man erklären, dass ein Atom elektrisch neutral ist, die Entstehung von Röntgenstrahlung oder radioaktiver Strahlung blieb aber ungeklärt.
-
John Dalton (1766-1844) leistete mit seiner Atomhypothese wichtige Beiträge zur Entwicklung der Atomtheorie

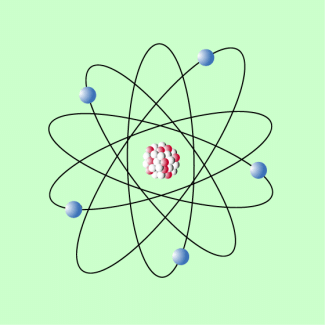
In den Jahren 1909/1910 führte ERNEST RUTHERFORD (1871-1937) mit seinen Mitarbeitern Versuche zum Durchgang von Alpha -Strahlung durch dünne Metallfolien durch. Nur ein geringer Teil der Strahlung wurde reflektiert, der größte Teil ging durch die Folien hindurch. Daraus zog RUTHERFORD den Schluss, dass der größte Teil des Atoms leer ist. Er entwickelte 1911 ein Modell, das dem Aufbau des Planetensystems ähnelt: Um einen positiv geladenen Kern, in dem die Masse des Atoms konzentriert ist, kreisen Elektronen auf elliptischen Bahnen. Die Stabilität der Atome konnte mit diesem Planetenmodell allerdings nicht erklärt werden. Genauere Hinweise zum rutherfordschen Atommodell sind in einem gesonderten Beitrag zu finden.
-
Rutherfordsches Atommodell
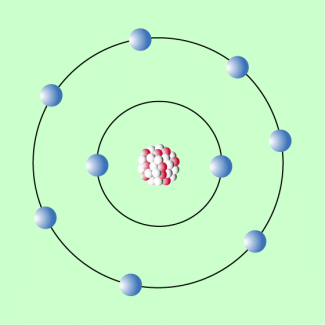
Eine Weiterentwicklung des Atommodells von RUTHERFORD stellt das bohrsche Atommodell dar, das der dänische Physiker NIELS BOHR (1885-1962) 1913 entwickelte: Nach diesem Modell bewegen sich die Elektronen auf bestimmten Bahnen um den Atomkern (Bild 4). Man spricht auch von Schalen und vom Schalenmodell. Wenn Energie zugeführt wird, können Elektronen auf eine kernfernere Bahn springen. Beim Zurückspringen wird diese Energie wieder frei. Allerdings konnte auch dieses Atommodell nicht alle Probleme klären, insbesondere nicht die Frage der Stabilität von Atomen. Genaue Hinweise zum bohrschen Atommodell sind ebenfalls in einem gesonderten Beitrag zu finden.
In den zwanziger Jahren des 20. Jahrhunderts kam es schließlich zur Entwicklung eines quantenmechanischen Atommodells, das sich allerdings nicht mehr anschaulich darstellen lässt, sondern nur noch mit mathematischen Mitteln beschreibbar ist. Wesentlichen Anteil daran hatten WERNER HEISENBERG, ERWIN SCHRÖDINGER und MAX BORN. Einzelne Aspekte lassen sich mit Orbitalmodellen verdeutlichen, die vorrangig in der Chemie in breiterem Umfange genutzt werden.
Auch die Vorstellungen vom Atomkern ändern sich
Im Laufe der Zeit änderten sich auch die Vorstellungen vom Aufbau des Atomkerns. War man zunächst von einem kompakten Gebilde ausgegangen, in dem sich die Masse des Atoms konzentriert, so zeigte sich spätesten mit der Entdeckung des Neutrons im Jahre 1932, dass auch der Atomkern strukturiert ist. Im Laufe der Zeit wurden eine ganze Reihe von Modellen entwickelt, mit denen man den Atomkern beschreiben kann. Das sind neben mathematischen Modellen auch anschauliche Modelle, wie etwa das Potenzialtopfmodell oder das Tröpfchenmodell. Genauere Informationen sind unter diese Stichwörtern zu finden
-
Bohrsches Atommodell
Suche nach passenden Schlagwörtern
- Orbitalmodell
- Quantenmechanisches Atommodell
- Tröpfchenmodell
- John Dalton
- Elektron
- brownsche Bewegung
- bohrsches Atommodell
- Atomhypothese
- Wiechert
- Radioaktive Strahlung
- Atom
- Thomson
- Potenzialtopfmodell
- Robert Brown
- Niels Bohr
- Albert Einstein
- rutherfordsches Atommodell
- Ernest Rutherford
- DEMOKRIT
- Rosinenmodell
- Kelvin
- Röntgenstrahlung
- Fitzgerald
- Planetenmodell
- Schalenmodell
- Katodenstrahlen

