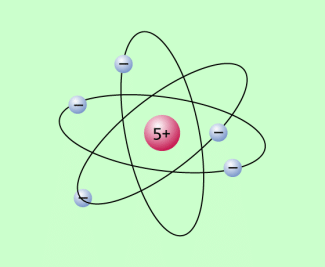
Rutherfordsches Atommodell
Im Ergebnis der experimentellen Untersuchungen zur Streuung von Alpha-Strahlung, die der britische Physiker ERNEST RUTHERFORD (1871-1937) durchführte, entwickelte er ein Atommodell. Er ging dabei davon aus, dass sich die Elektronen auf elliptischen Bahnen um den Atomkern bewegen, ähnlich wie die Bewegung der Planeten um die Sonne erfolgt. Man spricht deshalb auch vom Planetenmodell. Das rutherfordsche Atommodell war historisch ein bedeutsamer Schritt, wurde aber bereits 1913 vom bohrschen Atommodell abgelöst.
Rutherfordsches Atommodell
Im Ergebnis der experimentellen Untersuchungen zur Streuung von Alpha-Strahlung, die der britische Physiker ERNEST RUTHERFORD (1871-1937) durchführte, entwickelte er ein Atommodell. Er ging dabei davon aus, dass sich die Elektronen auf elliptischen Bahnen um den Atomkern bewegen, ähnlich wie die Bewegung der Planeten um die Sonne erfolgt. Man spricht deshalb auch vom Planetenmodell . Bild 1 zeigt dieses rutherfordsche Atommodell. Es stand in Übereinstimmung mit folgenden wichtigen Erkenntnissen, die bei vorhergehenden experimentellen Untersuchungen gewonnen wurden:
| a) | Die Masse eines Atoms ist nicht gleichmäßig verteilt, sondern im Atomkern konzentriert. |
| b) | In der Atomhülle befinden sich die negativen Ladungen, der Atomkern ist positiv geladen. Beide Ladungsarten sind gleich groß, sodass das Atom nach außen hin neutral ist. |
| c) | Die Abmessungen des Atomkerns sind klein gegenüber denen der Atomhülle. |
Historisch war das ein überaus bedeutsamer Schritt, der den damaligen Erkenntnisstand widerspiegelte, aber insgesamt doch nicht widerspruchsfrei war, auch nicht nach den Erkenntnissen der damaligen Zeit.
Die Vorteile des rutherfordschen Atommodells waren:
- Es ermöglichte die Erklärung der Ergebnisse der Streuversuche, die in den vorhergehenden Jahren durchgeführt wurden waren und die ergeben hatten, das Alpha-Strahlen, also doppelt positiv geladene Heliumkerne, dünne Goldfolien weitgehend geradlinig durchdringen und nur wenige der Alpha-Teilchen abgelenkt werden.
- Es beschreibt die Masse- und Ladungsverteilung im Atom in befriedigender Weise.
Diesen Vorteilen stehen aber auch deutliche Nachteile gegenüber, insbesondere folgende:
- Mit dem rutherfordschen Atommodell kann die Stabilität der Atome nicht erklärt werden. Geht man von der Bewegung von Elektronen auf kreisförmigen oder elliptischen Bahnen aus, dann treten Radialbeschleunigungen auf. Die Elektronen werden beschleunigt. Beschleunigte Elektronen senden elektromagnetische Wellen aus. Die Elektronen müssen nach dem Energieerhaltungssatz somit Energie verlieren und damit allmählich in den Atomkern stürzen.
- Es war bekannt, dass jedes Element charakteristische Spektrallinien aussendet. Die Entstehung dieser Spektrallinien konnte mit dem rutherfordschen Atommodell nicht gedeutet werden.
Damit war schon nach kurzer Zeit klar: Das rutherfordsche Atommodell ist ein erstes Modell, das bestimmte experimentelle Ergebnisse erklären kann, andere aber nicht. Die Weiterentwicklung war damit vorgezeichnet. Sie vollzog sich wenig später mit der Entwicklung des bohrschen Atommodells.
-
Das rutherfordsche Atommodell: Die negativ geladenen Elektronen bewegen sich um den positiv geladenen Atomkern.