Grundexperimente zur Atomphysik
Für die Entstehung der Atomphysik und die Durchsetzung der Atomhypothese spielten eine Reihe von grundlegenden Experimenten und Beobachtungen eine herausragende Rolle. Dazu gehören u.a. die Streuversuche von PHILIPP LENARD und ERNEST RUTHERFORD, aber auch die spektroskopischen Untersuchungen, die in der zweiten Hälfte des 19. Jahrhunderts von verschiedenen Physikern durchgeführt und interpretiert wurden. In dem Beitrag sind ausgewählte Experimente dargestellt und in ihrer Bedeutung für die Entwicklung der Atomphysik charakterisiert.
Wir stellen nachfolgend einige dieser Experimente dar. Dabei ist zu beachten, dass dies nur ein sehr kleiner Ausschnitt aus den vielfältigen Forschungen sein kann, die Ende des 19. Jahrhunderts und Anfang des 20. Jahrhunderts durchgeführt wurden, um die Struktur der Materie genauer zu erfassen.
Streuversuche von LENARD
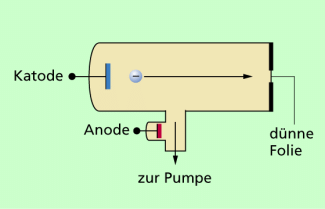
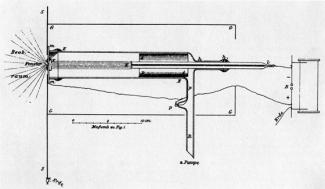
Der deutsche Physiker PHILIPP LENARD (1862-1947) hat sich intensiv mit Katodenstrahlen (schnell bewegten Elektronen) und deren Eigenschaften beschäftigt. Als hervorragender Experimentator konstruierte er u.a. eine spezielle Vakuumröhre, so wie sie in Bild 1 dargestellt ist.
Eine Originalzeichnung dieser Vakuumröhre ist in Bild 2 dargestellt. Sie besteht aus einer Katode und einer seitlich angebrachten Anode. Am Ende dieser Katodenstrahlröhre war eine kleine Öffnung von weniger als 2 mm Durchmesser angebracht, die durch eine dünne Aluminiumfolie (Dicke etwa 3/1000 mm) luftdicht abgeschlossen wurde. Diese Anordnung wird nach ihren Erfinder auch als LENARD-Fenster bezeichnet. In der Röhre wird durch Auspumpen der Luft ein Vakuum hergestellt. Durch die Spannung zwischen Anode und Katode werden die aus der Katode austretenden Elektronen beschleunigt und bewegen sich infolge ihrer Trägheit näherungsweise geradlinig in Richtung Fenster (dünne Folie). LENARD, ein Schüler von HEINRICH HERTZ, führte damit folgende Versuche durch: Katodenstrahlen wurden auf die dünne Folie gelenkt. Sie treten in nachweisbarer Intensität durch das LENARD-Fenster hindurch. LENARD beobachtete dabei:
„Kathodenstrahlen bringen die Luft zum matten Leuchten. Ein Schimmer bläuliches Lichtes umgibt das Fenster; er ist am hellsten in der Nähe des Fensters selbst, nach außen hin ohne deutliche Begrenzung; weiter als etwa 5 cm vom Fenster reicht er nicht ... Mit zunehmender Entfernung nimmt die Erscheinung an Intensität rasch ab, sie verschwindet in einem Abstand von 6 oder 8 cm ...“
Er deutete diese Ergebnisse folgendermaßen:
„Nach dem hier beobachteten Verhalten der Gase zu schließen müssen die Äthervorgänge, welche das Wesen der Kathodenstrahlen ausmachen, Vorgänge von so außerordentlicher Feinheit sein, dass Dimensionen von molekularer Größenordnung in Betracht kommen. Selbst gegen Licht von kleinster bekannter Wellenlänge verhält sich die Materie noch wie stetig den Raum erfüllend, den Kathodenstrahlen gegenüber ist dagegen das Verhalten selbst elementarer Gase das nichthomogener Medien; es scheint hier schon jedes einzelne Molekül als gesondertes Hindernis aufzutreten.“
Aus dem Durchgang von Katodenstrahlen durch dünne Folien und der damit verbundenen Absorption entwickelte LENARD seine Dynamidenhypothese, die besagt: Das Kraftzentrum des Atoms ist viel kleiner als das Atomvolumen.
Damit gab er wichtige Impulse für künftige Atommodelle.
Der Physiker EMIL WIECHERT schrieb 1884:
„Der Umstand, dass die elektrischen Atome (Elektronen - der Autor) in den Kathodenstrahlen eine so vielmals kleinere Masse haben als chemische Atome, wirft auf die Lenardsche Erfahrung über die Absorption der Katodenstrahlen ein sehr interessantes Licht und rückt sie in unserem Verständnis bedeutend näher. So brauchen wir z.B. nur der sehr viel kleineren Masse entsprechend auch die Dimensionen sehr viel kleiner anzunehmen, um es begreiflich zu finden, das die chemischen Atome gegenüber den elektrischen nicht die gleiche Undurchdringlichkeit zeigen wie untereinander, dass vielmehr ihre Masse allein entscheiden ist.“
JOSEPH JOHN THOMSON, der Direktor des berühmten Cavendish-Laboratoriums in Cambridge, der die lenardschen Experimente sehr genau verfolgt hatte und auch selbst eine Reihe bedeutsamer Experimente mit Katodenstrahlen durchführte, schrieb rückblickend in seinen autobiografischen Aufzeichnungen:
„Nach langen Erwägungen schien es mir, dass aus den Versuchen die folgenden Schlußfolgerungen zu ziehen sind: Erstens, dass die Atome nicht unteilbar sind, denn negative elektrische Partikel können von ihnen weggerissen werden durch die Wirkung elektrischer Kräfte ... Zweitens, dass die Partikel alle von derselben Masse sind und die gleiche Ladung negativer Elektrizität tragen, aus welcher Art von Atomen sie auch stammen, und dass sie Bestandteile aller Atome sind. Drittens, dass die Masse dieser Teilchen geringer ist als der tausendste Teil eines Wasserstoffatoms.“
RUTHERFORDs Streuversuche
Der britische Physiker ERNEST RUTHERFORD (1871-1937) griff den Gedanken des oben beschriebenen lenardschen Experiments auf. Er nutzte aber nicht schnelle Elektronen, sondern Alpha-Teilchen, also doppelt positiv geladene Heliumkerne. Er und seine Mitarbeiter HANS GEIGER und ERNEST MARSDEN bestrahlten mit diesen Teilchen dünne Goldfolie und stellte dabei fest, dass der größte Teil der Alpha-Strahlung die Folien fast ungehindert durchdrang und nur wenige Teilchen abgelenkt wurden. Bild 3 zeigt den Versuchsaufbau und rechts die Deutung des Ergebnisses. Einige Aussagen dazu sind auch in dem Beitrag „ Atombau im Original “ auf der CD zu finden.
Aus den Streuversuchen von RUTHERFORD ergeben sich einige bedeutsame Folgerungen für den Atombau, die RUTHERFORD der Formulierung seines Atommodells zugrunde legte:
| Die weitaus meisten passieren die Atome ungehindert. Das massereiche und geladene Objekt im Atom - der Atomkern - ist daher sehr klein. Sein Radius, der Kernradius, ist etwa 100.000-mal kleiner als der Atomradius. | |
| Da die relativ masereichen in einigen Fällen reflektiert werden, muss ein undurchdringliches Objekt im Atom vorhanden sein. aus den Stoßgesetzen folgt, dass dieses Objekt (der Atomkern) viel Masse in sich vereint. | |
| Das streuende Objekt im Atom (der Atomkern) ist positiv geladen. |
Spektroskopische Versuche
Um 1860 hatten der Physiker G. R. KIRCHHOFF (1824-1887) und der Chemiker R. W. BUNSEN (1811-1899) die Spektralanalyse entwickelt. In den nachfolgenden Jahren wurden zahlreiche spektralanalytische Untersuchungen durchgeführt und dabei auch die Spektren einzelner Stoff sehr genau untersucht. Dabei wurde u.a. festgestellt, dass man die Spektrallinien eines Elements so anordnen sein, dass man für die Spektrallinien sogenannte Serienformeln angeben kann. Für das Wasserstoffatom lautet die Serienformel:
Mit n = 2 und m = 3, 4, ... ergeben sich die Frequenzen für die Spektrallinien des Wasserstoffs, die im sichtbaren Bereich liegen. Die betreffende Serienformel wurde schon 1885 von dem schweizer Physiker JOHANN BALMER (1825-1898) bekanntgegeben. Neben dieser BALMER-Serie gibt es für Wasserstoff noch die LYMAN-Serie (n = 1), die PASCHEN-Serie (n = 3), die BRACKETT-Serie (n = 4) und die PFUND-Serie (n = 5).
Alle Serien sind nach Physikern benannt, die die betreffenden Serien erforschten. Diese spektroskopischen Versuche gaben wichtige Hinweise auf die energetischen Verhältnisse in den Atomen.
Suche nach passenden Schlagwörtern
- Berechnung
- Spektralanalyse
- spektroskopische Untersuchungen
- PFUND-Serie
- Streuversuche von RUTHERFORD
- LYMAN-Serie
- Kathodenstrahlen
- Streuversuche von Lenard
- Grundversuche zur Atomphysik
- Wiechert
- Balmer-Serie
- Thomson
- spektralanalytische Untersuchungen
- Serienformeln
- BRACKETT-Serie
- RUTHERFORD
- Grundexperimente zur Atomphysik
- Lenard-Fenster
- PASCHEN-Serie
- Dynamidenhypothese
- Rechenbeispiel
- Lenards Streuversuche
- Katodenstrahlen
- Rutherfords Streuversuche