Halogenkohlenwasserstoffe
Halogenkohlenwasserstoffe sind eine große Stoffklasse, die sich aus den Halogenalkanen, den halogenierten Aromaten und anderen Kohlenwasserstoffen mit einem oder mehreren Halogenatomen (F, Cl, Br, I) im Molekül zusammensetzt. Die Verbindungen unterscheiden sich aufgrund der polaren Halogen-Kohlenstoff-Bindung deutlich von den nicht halogenierten Kohlenwasserstoffen und wurden bis Ende der 70er-Jahre des 20. Jahrhunderts noch vielfach verwendet.
Inzwischen weiß man aber, dass ein großer Teil der Halogenkohlenwasserstoffe giftig und/ oder kanzerogen ist. Außerdem ist die Ozon abbauende Wirkung der Fluorchlorkohlenwasserstoffe belegt, sodass die Anwendung dieser Verbindungen in der Praxis rückläufig ist. Ausnahmen stellen Fluorkohlenwasserstoffe und der Kunststoff PVC dar, die nur schwer gleichwertig ersetzt werden können.
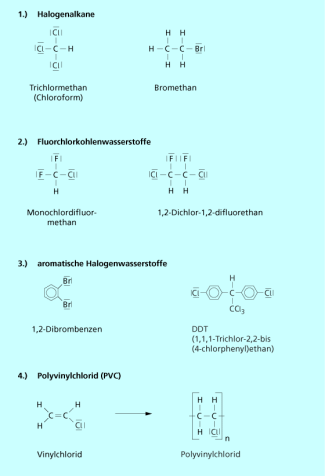
Halogenalkane (Alkylhalogenide) leiten sich von den Alkanen durch Ersatz eines oder mehrerer Wasserstoffatome durch Halogenatome ab (Bild 1). Chlorkohlenwasserstoffe enthalten in ihrem Molekül ein oder mehrere Chloratome, Bromkohlenwasserstoffe enthalten Brom-, Fluorkohlen-wasserstoffe Fluoratome. FCKW (Fluor-Chlor-Kohlenwasserstoffe) besitzen sowohl Chlor- als auch Fluoratome. Halone enthalten zusätzlich zu Fluor und Chlor noch Brom im Molekül. Auch halogenierte Aromaten wie polychlorierte Biphenyle (PCB) und Dioxine zählen zu den Halogenkohlenwasserstoffen, allerdings nicht zu den Halogenalkanen.
-
Verschiedene Halogenkohlenwasserstoffe
Darstellung und technische Synthese
Viele Halogenalkane lassen sich durch Umsetzung der Alkane mit den Elementen darstellen. Auch die industrielle Herstellung der Chlor- und Bromalkane erfolgt durch direkte Halogenierung der Kohlenwasserstoffe nach dem Mechanismus der radikalischen Substitution. Je nach Stoffmengenverhältnis der Edukte erhält man die unterschiedlich substituierten Produkte.
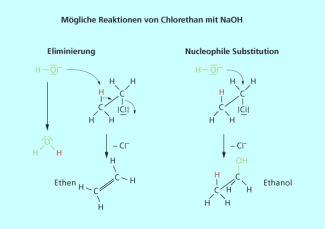
Halogenalkane kann man auch durch Reaktion eines Alkohols mit einem Halogenwasserstoff nach dem Mechanismus einer nucleophilen Substitution herstellen..
CH3OH + HCl CH3Cl + H2O
Eine weitere Herstellungsmöglichkeit besteht in der Addition von Halogenen an Alkene (Halogenierung) oder Halogenwasserstoffen an Alkene (Hydrohalogenierung).
![]()
![]()
-
Nucleophile Substitution und Eliminierung sind die typischen Reaktionen der Halogenalkane.
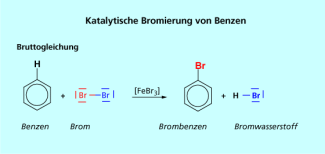
Aromatische Halogenkohlenwasserstoffe müssen dagegen durch elektrophile Substitution in Gegenwart von LEWIS-Säuren als Katalysatoren synthetisiert werden.
-
Bruttogleichung der Synthese von Brombenzen (elektrophile Substitution am Aromaten).
Struktur und Eigenschaften
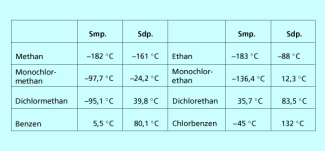
Die Polarität der Kohlenstoff-Halogen-Bindungen führt zu unterschiedlich stark ausgeprägten Dipolmomenten der Moleküle. Deswegen und wegen der größeren molaren Massen sind die Schmelz- und Siedepunkte höher als die der vergleichbaren Alkane. Der Unterschied ist um so größer, je höher die Zahl der Halogenatome im Molekül und je größer das Dipolmoment ist. Viele Halogenalkane sind farblose Flüssigkeiten mit einem charakteristischen süßlichen Geruch. Trotz ihres Dipolmoments sind sie in Wasser nicht, in vielen organischen Lösungsmitteln jedoch gut löslich. Chloralkane sind gut fettlöslich. Viele Halogenalkane wirken narkotisch.
Die halogenierten Aromaten sind chemisch sehr beständig und ebenfalls fettlöslich.
Bedeutung und Verwendung von Halogenalkanen
Das Einsatzgebiet der preiswert herzustellenden und chemisch beständigen Halogenalkane war früher außerordentlich vielfältig. Sie wurden als lang wirkende Insektizide (DDT), Pestizide (Brommethan), Kühlmittel (FCKW), Treibgase und in Feuerlöschern (Halone) verwendet. In der Medizin setzte man Chloroform als Narkotikum ein. Erkrankungen wie Malaria, Typhus oder Cholera konnten durch die Bekämpfung ihrer Überträger stark eingedämmt werden. Viele Halogenalkane sind sehr gute Lösungsmittel für hydrophobe Stoffe und wurden deshalb als Lösungsmittel zur Textilreinigung und Reinigungsmittel in der Metallindustrie (Tetrachlormethan, Trichlorethen (Tri) und Tetrachlorethen (Ter)) verwendet.
Wegen ihrer Nichtbrennbarkeit und ihrer günstigen elektrischen Isolierwirkung dienten PCB auch als Kühlmittel in Transformatoren.
-
Vergleich der Schmelz- und Siedepunkte von halogenierten und nicht halogenierten Kohlenwasserstoffen
Umweltschäden durch Halogenkohlenwasserstoffe
Halogenalkane, insbesondere niedermolekulare Chlorfluoralkane, umgangssprachlich als Fluorchlorkohlenwasserstoffe (FCKW) bezeichnet, sind mitverantwortlich für Zerstörung der Ozonschicht in der Stratosphäre. Diese Verbindungen sind chemisch sehr stabil und leicht flüchtig. Sie können deshalb in die höheren Schichten der Atmosphäre gelangen und dort Radikale ausbilden, die Ozonmoleküle spalten. Die Chlorradikale werden in einem katalytischen Reaktionszyklus immer wieder zurückgebildet und können mehrere Tausend Ozonmoleküle zerstören. Insgesamt wird über diesen Mechanismus mehr Ozon abgebaut als im gleichen Zeitraum durch die UV-Strahlung nachgebildet werden kann. Der Ozongehalt in der Stratosphäre nimmt ab. Trotz zunehmender Verbote der Verwendung von FCKW ist aufgrund der langen Verweildauer dieser Stoffe mit einer schnellen Behebung der Situation nicht zu rechnen. Es sind aber schon Anzeichen einer Besserung zu erkennen, sodass innerhalb der nächsten 20-30 Jahre das Ozonloch in der Antarktis kein Problem mehr darstellen sollte.
Unter den aromatischen Halogenkohlenwasserstoffen findet man eine Reihe starker Umweltgifte. Dadurch dass diese Verbindungen stabil und fettlöslich sind, gelangen sie in die Nahrungskette und werden bei den Endkonsumenten der Nahrungskette, wie Raubvögeln, Robben, Eisbären und auch im menschlichen Körper angereichert. Die Abbauprodukte im Stoffwechsel wirken häufig cancerogen. Verbindungen wie Dichlor-diphenyl-trichlorid (DDT) und polychlorierte Biphenyle (PCB) wurden in der Vergangenheit als Insektizide oder als Additive zu Werkstoffen genutzt. Ihre Anwendung ist inzwischen verboten.
Ebenfalls sehr starke Umweltgifte sind chlorierte Dibenzo-para-dioxine, die umgangssprachlich als Dioxine bezeichnet werden. Diese wurden zwar nie gezielt technisch synthetisiert und angewendet. Sie entstehen jedoch als unerwünschte Nebenprodukte bei der Synthese von Halogenkohlenwasserstoffen und bei deren Entsorgung. Aufgrund der außerordentlichen Stabilität der Dioxine reichern sie sich ebenfalls im Fettgewebe an und gelangen in die Nahrungskette. Sowohl zu den PCB als auch zu den Dioxinen findet man ausführliche Informationen in entsprechenden anderen Beiträgen.
-
Ozonabbau durch Chlorradikale aus FCKW

Warum sind gerade halogenierte Kohlenwasserstoffe für so viele Umweltprobleme verantwortlich? Es könnte daran liegen, dass es nur wenige natürliche organische Halogenverbindungen gibt, vor allem fast keine polyhalogenierten. Deshalb haben sich in der Evolution nur wenige Mikroorganismen auf den Abbau dieser Verbindungen spezialisiert.
Die vom Menschen hergestellten und genutzten halogenierten Kohlenwasserstoffe sind nun in vielen Fällen gerade solche polyhalogenierten Verbindungen, die deshalb lange in der Umwelt verbleiben.
Die meisten umweltschädlichen Chlorkohlenwasserstoffe sind in der BRD seit langem verboten. Auch in anderen Ländern wurden diese Stoffe inzwischen zum großen Teil ersetzt. So verwendet man Fluorkohlenwasserstoffe (FKW) anstelle der FCKW als Kühlmittel und Butan als Treibgas. Chloroform (Trichlormethan) wurde z. B. durch das verträglichere Halothan als Anästhetikum ersetzt.
Das Hauptanwendungsgebiet liegt heute in der Kunststoffherstellung des Polyvinylchlorids (PVC). Dazu benötigt man das Chlorethen als Ausgangsstoff. Auch dieser Halogenkohlenwasserstoff ist giftig und führt bei längerem Kontakt zu Haut- und Gelenkbeschwerden. Außerdem entstehen bei der PVC-Verbrennung ebenfalls Dioxine, sodass große Anstrengungen unternommen werden, PVC durch andere Kunststoffe zu ersetzen. PVC ist jedoch in der Herstellung so preiswert und in den Eigenschaften so flexibel (Bild 6 und 7), dass es noch Jahre dauern wird, gleichwertigen Ersatz zu finden.
-
Gegenstände aus Hart-PVC

-
Gegenstände aus Weich-PVC


