Bestimmung der Raumstruktur von Molekülen mit dem Elektronenpaarabstoßungsmodell
Das Elektronenpaarabstoßungsmodell ist ein sehr einfaches Hilfsmittel zur Bestimmung der räumlichen Struktur von Molekülverbindungen der allgemeinen Zusammensetzung mit x = 1 bis 6. Dabei geht man zweckmäßigerweise in folgenden Schritten vor:
| 1. | Überprüfen des Bindungstyps (kovalente Bindung). |
| 2. | Aufstellen der Lewis-Formel mit allen Elektronenpaaren. |
| 3. | Bestimmen der Anzahl der gebundenen Atome (B) und der freien Elektronenpaare (E) am Zentralatom. |
| 4. | Ermitteln des Molekültyps und der dazugehörigen Raumstruktur. |
| 5. | Abschätzen der Deformation der Struktur durch freie Elektronenpaare und unterschiedlich gebundene Atome. |
Das Elektronenpaarabstoßungsmodell ist nur auf kovalente Verbindungen, nicht auf Ionen- und nur eingeschränkt auf Komplexverbindungen anwendbar.
Die räumliche Struktur von Molekülen ist von großer Bedeutung für ihre chemische Reaktivität und für ihre physikalischen Eigenschaften. So ergibt sich der Dipolcharakter des Wassers und damit z. B. die Lösungsmitteleigenschaften aus der gewinkelten Molekülstruktur. Diese kann aus der Valenzbindungstheorie mit dem Modell der Hybridisierung abgeleitet werden.
Deutlich einfacher ist die Voraussage mithilfe des sogenannten Elektronenpaarabstoßungsmodells bzw. VSEPR-Modell (engl. valence shell electron pair repulsion). Dieses Modell kommt ohne quantenmechanische Berechnungen aus und basiert hauptsächlich auf der leicht verständlichen Tatsache, dass sich Elektronenpaare an einem Atom gegenseitig abstoßen und deshalb den größtmöglichen Abstand zueinander einnehmen. Es ist allerdings ausschließlich auf Molekülverbindungen anwendbar, also auf Teilchen, in denen die Atome kovalent gebunden sind.
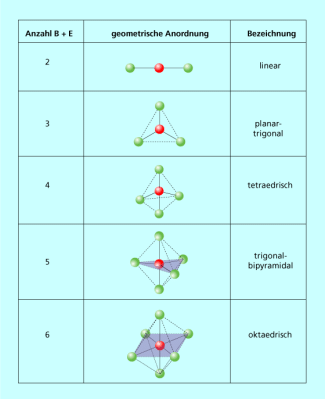
Zur Bestimmung der Raumstruktur eines Moleküls stellt man zuerst die Lewis-Formel auf und zählt alle gebundenen Atome „B“ und die nicht bindenden Elektronenpaare „E“ am Zentralatom „A“. Aufgrund der wechselseitigen Abstoßung zwischen den Elektronenpaaren bilden diese den größtmöglichen Winkel untereinander aus. Aus der Summe von B und E ergibt sich dadurch eine für die Gesamtzahl der Elektronenpaare am Zentralatom typische Konfiguration (Bild 1).
-
Ideale geometrische Anordnungen von 1 bis 6 Elektronenpaaren an einem Zentralatom
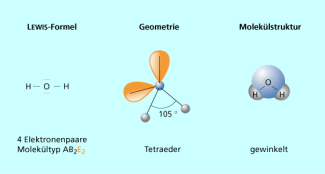
Diese entspricht jedoch nur dann der räumlichen Molekülstruktur, wenn es sich dabei ausnahmslos um bindende Elektronenpaare zu anderen Atomen B handelt. Die "sichtbare" Raumstruktur ergibt sich nur aus der Lage der verschiedenen Atome zueinander. Nicht bindende Elektronenpaare sind zwar nicht "sichtbar", beeinflussen aber dennoch die Geometrie der Molekülstruktur. Deutlich wird das beispielweise am Wassermolekül (Bild 2). Sauerstoff als Zentralatom verfügt über zwei nicht bindende bzw. freie Elektronenpaare und bindet zwei Wasserstoffatome. Um einen maximalen Abstand zu realisieren, bilden die vier Elektronenpaare ein Tetraeder mit einem Winkel von ca. 109°. Die reale Molekülstruktur ergibt sich aber nur aus der Lage der Atome zueinander und man erhält so die für diesen Molekültyp eine typische gewinkelte Struktur.
-
Räumliche Struktur des Wassermoleküls
Raumstrukturen bei zwei bis vier Elektronenpaaren am Zentralatom
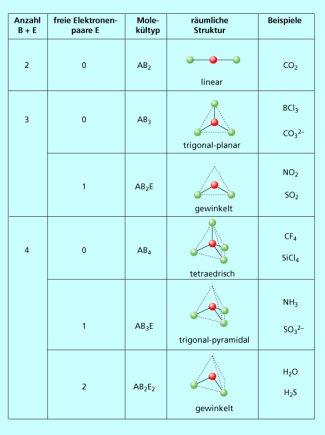
Auf diese Weise kann man für jeden Molekültyp die Konfiguration der Elektronenpaare und die daraus resultierende räumliche Struktur der Moleküle ableiten. Besonders einfach ist das, wenn maximal vier Elektronenpaare oder Atome am Zentralatom gebunden sind (Bild 3). Bei zwei Elektronenpaaren ergibt sich immer eine lineare Raumstruktur , da sich diese immer entgegengesetzt am Zentralatom anordnen und einen Winkel von 180° bilden. Dabei ist zu beachten, dass Mehrfachbindungen zu anderen Atomen immer wie ein einziges bindendes Elektronenpaar behandelt werden!
Aus der tetraedrischen Anordnung von insgesamt vier Elektronenpaaren resultieren schon drei mögliche Molekültypen mit unterschiedlicher Raumstruktur.
-
Molekültypen und Raumstrukturen bei zwei bis vier Elektronenpaaren am Zentralatom
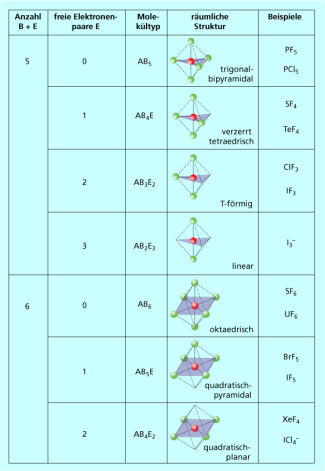
Raumstrukturen bei fünf und sechs Elektronenpaaren am Zentralatom
Noch mehr Möglichkeiten existieren, wenn man Zentralatome mit 5 oder 6 Elektronenpaaren betrachtet (Bild 4). Fünf Elektronenpaare sind immer trigonal-bipyramidal angeordnet und es ergeben sich je nach Anzahl der tatsächlich gebundenen Atome fünf unterschiedliche Molekültypen und Raumstrukturen. Dabei ist von besonderer Bedeutung, dass freie Elektronenpaare erstaunlicherweise einen größeren Platzbedarf am Zentralatom haben als gebundene Atome. Aus diesem Grund liegen die freien Elektronenpaare bei der trigonalen Bipyramide (B + E = 5) immer in der Ebene, da der Winkel hier 120° beträgt und größer als der Winkel (90°) zu den axialen Elektronenpaaren ist. Beim Oktaeder (B + E = 6) sind alle Positionen gleichwertig und es gibt praktisch nur drei mögliche Molekültypen und dazugehörige Raumstrukturen.
-
Molekültypen und Raumstrukturen bei fünf und sechs Elektronenpaaren am Zentralatom
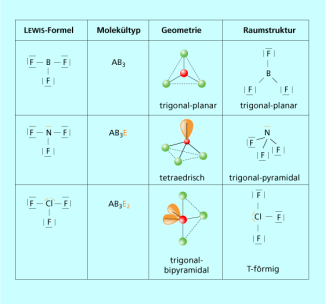
Moleküle ähnlicher Zusammensetzung können also völlig unterschiedliche Raumstrukturen aufweisen, wenn am Zentralatom noch freie Elektronenpaare vorhanden sind (Bild 5). So ist (Molekültyp ) trigonal-planar, (Molekültyp ) ist trigonal-pyramidal und (Molekültyp ) ist T-förmig. Entscheidend ist immer die Gesamtzahl der Elektronenpaare am Zentralatom und damit letztlich dessen Hybridisierung.
-
Verschiedene Raumstrukturen vieratomiger Moleküle
Einflussfaktoren auf die Größe der Bindungswinkel
Oftmals beobachtet man jedoch geringfügige Abweichungen bzw. Deformationen der idealen Geometrie, die durch den Molekültyp vorgegeben ist. So führt beispielsweise der größere Platzbedarf der freien Elektronenpaare dazu, dass der Bindungswinkel zwischen den bindenden Elektronenpaaren etwas zusammengedrückt wird. Daher ist der H–O–H-Bindungswinkel im Wassermolekül nicht gleich dem Tetraederwinkel, sondern mit ca. 105° etwas kleiner (Bild 2).
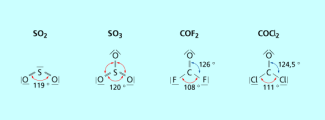
Auch unterschiedlich gebundene Atome haben einen unterschiedlichen Platzbedarf. Eine Mehrfachbindung beansprucht z. B. mehr Platz als eine Einfachbindung, jedoch etwas weniger als ein freies Elektronenpaar. Deshalb beträgt der Bindungswinkel im SO2-Molekül nur ca. 119° statt der erwarteten 120° der trigonal-planaren Anordnung (Bild 6).
Bei Mehrfachbindungen handelt es sich natürlich um zwei oder drei bindendeElektronenpaare. Diese werden bei der Ermittlung der Geometrie nach dem EPA-Modell jedoch wie ein einziges bindendes Elektronenpaar mit einem etwas größerem Platzbedarf betrachtet.
Eine Deformation der Struktur wird auch dann beobachtet, wenn unterschiedliche Atome am Zentralatom gebunden sind. Der Platzbedarf hängt jedoch nicht von der Atomgröße, sondern von ihrer Elektronegativität ab. Elektronegative Atome ziehen das Bindungselektronenpaar stärker zu sich heran und beanspruchen daher weniger Platz am Zentralatom als elektropositive Atome. Bei drei gebundenen Atomen und keinem freien Elektronenpaar beträgt der ideale Bindungswinkel in der trigonal-planaren Struktur 120°. Dies ist bei drei gleichen Atomen wie im SO3-Molekül der Fall. Ist nur eines der drei Atome doppelt gebunden, beansprucht es einen größeren Platz als die anderen. Sind diese Atome auch noch stark elektronegativ, dann können sich die Bindungswinkel wie im COF2-Molekül deutlich von 120° unterscheiden (Bild 6). Stark elektronegative Bindungspartner wie Fluor kontrahieren das Elektronenpaar in der entsprechenden Bindung. Dadurch können sich andere Elektronenpaare im Molekül etwas weiter „ausdehnen“.
Die Regeln für die Voraussage der Raumstruktur von Molekülen mit dem Elektronenpaarabstoßungsmodell können folgendermaßen zusammengefasst werden:
| 1. | Elektronenpaare versuchen durch größtmöglichen Abstand der gegenseitigen Abstoßung auszuweichen. | |
| 2. | Für jede Anzahl (x = 1 bis 6) an gebundenen Atomen und freien Elektronenpaaren am Zentralatom gibt es eine ideale Geometrie. Daraus ergibt sich die für einen bestimmten Molekültyp typische Raumstruktur. | |
| 3. | Abweichungen bzw. Deformationen der idealen Raumstruktur resultieren aus dem unterschiedlichen Platzbedarf der Elektronenpaare: | |
| a) | freie Elektronenpaare benötigen mehr Platz als gebundene Atome | |
| b) | Doppelbindungen benötigen mehr Raum als Einfachbindungen | |
| c) | Je elektronegativer die am Zentralatom gebundenen Atome sind, um so weniger Platz benötigen die bindenden Elektronenpaare. | |
Das Elektronenpaarabstoßungsmodell ist ausschließlich auf Moleküle und Molekül-Ionen anwendbar, nicht auf Salze und nur eingeschrälnkt auf Komplexverbindungen.
-
Einflussfaktoren auf die Größe der Bindungswinkel