Bohrsches Atommodell
Der dänische Physiker NIELS BOHR (1885-1962) entwickelte 1913 das von dem britischen Physiker ERNEST RUTHERFORD (1871-1937) im Jahre 1911 angegebene Atommodell weiter, wobei er das Kern-Hülle-Modell mit Quantenvorstellungen verband. Bohr formulierte für sein Atommodell, das man als bohrsches Atommodell bezeichnet, einige grundlegende Postulate. Ein Vorteil dieses Atommodells war, dass man mit ihm die Emission und Absorption von Strahlung erklären konnte. Für Wasserstoff konnten auch die Spektrallinien berechnet werden. Entscheidende Nachteile waren, dass es bei anderen Atomen als Wasserstoff versagt und im Widerspruch zu quantenphysikalischen Erkenntnissen von der Vorstellung bestimmter Bahnen der Elektronen ausgeht.
Vom rutherfordschen zum bohrschen Atommodell
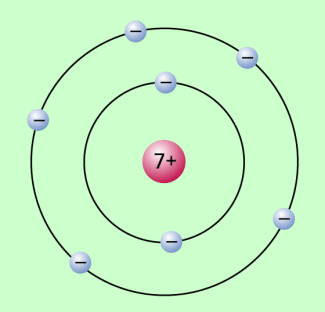
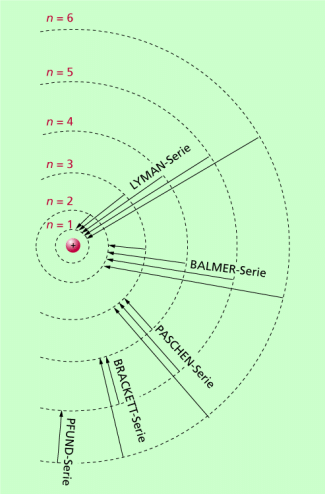
Das 1911 von dem britischen Physiker ERNEST RUTHERFORD (1871-1937) vorgestellte Atommodell, zu dem er vor allem durch seine Streuversuche von Alpha-Strahlen an dünnen Goldfolien gekommen war, erwies sich schnell als unzulänglich. Insbesondere konnten mit ihm weder die Stabilität der Atome noch die Entstehung von Spektrallinien erklärt werden. Einen entscheidenden Schritt bei der Weiterentwicklung des rutherfordschen Atommodells ging 1913 der dänische Physiker NIELS BOHR (1885-1962): Er verband das von RUTHERFORD angegebene Kern-Hülle-Modell mit Quantenvorstellungen, insbesondere mit der quantenhaften Emission und Absorption von Strahlung, wie sie erstmals MAX PLANCK (1858-1947), der Begründer der Quantentheorie, im Jahre 1900 vorgestellt hatte und wie sie von ALBERT EINSTEIN (1879-1955) im Jahre 1905 mit seiner Lichtquantenhypothese weiterentwickelt wurde. Bild 1 zeigt das bohrsche Atommodell: Um einen positiv geladenen Atomkern bewegen sich in der Atomhülle die Elektronen auf bestimmten kreisförmigen Bahnen um den Kern.
Die bohrschen Postulate
Zu genaueren Kennzeichnung seines Modells stellte BOHR einige Forderungen auf, die man meist als bohrsche Postulate bezeichnet. Von ihrem Charakter her sind es Forderungen, die er teilweise aus dem damaligen Erkenntnisstand ableitete, teilweise aber auch recht willkürlich formulierte, um ein Modell zu erhalten, das nicht im Widerspruch zur Realität steht. BOHR selbst hat zwei Postulate formuliert. Im Interesse einer besseren Überschaubarkeit gliedern wir diese Postulate noch einmal auf.
Die Stabilität der Atome, die mit dem rutherfordschen Atommodell nicht erklärt werden konnte, wird nach BOHR durch folgende Forderung garantiert:
(1) Es existieren im Atom stabile Bahnen, auf denen sich Elektronen bewegen, ohne Energie abzugeben.
Die Frage, welche Bahnen überhaupt möglich sind und welche nicht, beantwortete BOHR durch die Einbeziehung des planckschen Wirkungsquantums und formulierte:
(2) Der Bahndrehimpuls L eines Elektrons ist ein ganzzahliges Vielfaches von . Es gilt:
Mit den ganzen Zahlen n = 1, 2, ... werden die im Atom erlaubten Bahnen gekennzeichnet. Die Zahl n bezeichnet man als Hauptquantenzahl. Berechnet man für Wasserstoff mit einem Elektron im Grundzustand und damit für n = 1 den Radius, dann erhält man einen Wert von:
Dieser Wert für den Radius des Wasserstoffatoms wird als bohrscher Radius bezeichnet.
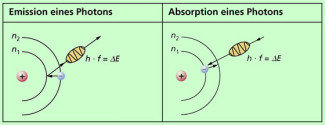
Auf welche Weise Photonen (Quanten) abgegeben oder aufgenommen werden, ist in zwei weiteren Postulaten formuliert.
(3) Die Emission oder Absorption von Photonen erfolgt genau dann, wenn ein Elektron von einer erlaubten Bahn auf eine andere erlaubte Bahn wechselt.
Der energetische Aspekt eines solchen Bahnwechsels wird im letzten Postulat formuliert:
(4) Jeder erlaubten Elektronenbahn entspricht eine bestimmte Energie E der Elektronen. Wechselt ein Elektron die Bahn, so ist die Energie des emittierten bzw. absorbierten Photons gleich der Energiedifferenz der Bahnen. Es gilt:
Die Energie der kernnäheren Bahn ist dabei kleiner als die der kernferneren Bahn. Damit gelangt ein Elektron bei der Emission eines Photons, also bei Energieabgabe, auf eine kernnähere Bahn. Bei der Absorption wird dem Atom Energie zugeführt. Das Elektron wird auf eine kernfernere Bahn gehoben.
Bahnradius und Frequenz der abgestrahlten Photonen
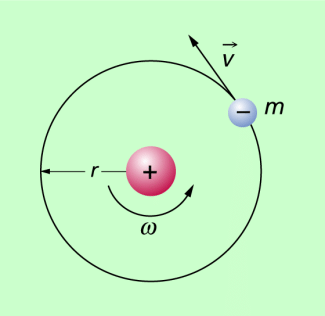
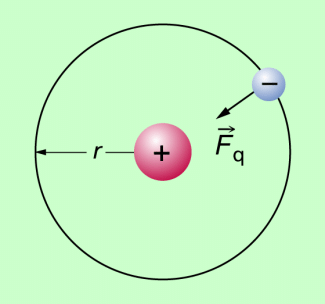
Der oben genannte bohrsche Radius ergibt sich aus folgenden Überlegungen: Wenn sich ein Elektron mit konstantem Betrag der Geschwindigkeit auf einer Kreisbahn um den Atomkern bewegt, so ist die Radialkraft die coulombsche Kraft zwischen negativ geladenem Elektron und positiv geladenem Atomkern. Beide haben die Ladung e. Man kann also schreiben:
Die Frequenz der abgestrahlten Photonen ergibt sich folgendermaßen: Auf einer bestimmten Bahn hat ein Elektron aufgrund seiner Bewegung kinetische Energie und auch potenzielle Energie, da es sich im elektrischen Feld des Atomkerns befindet. Für diese Energien gilt:
Eine solche Gleichung wird als Serienformel bezeichnet.
Spektrallinien des Wasserstoffs
Mithilfe der zuletzt genannten Serienformel lassen sich die Spektrallinien für das Wasserstoffatom berechnen. Die Serien für die Hauptquantenzahlen 1-5 sind in Bild 5 dargestellt. Die verschiedenen Serien sind nach Forschern benannt, die sich mit den betreffenden Serien intensiver beschäftigt haben.
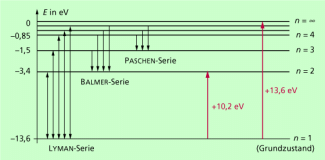
Die der Energiezustände der Elektronen in der Atomhülle lassen sich auch in einem Energieniveauschema, auch Termschema genannt, darstellen, so wie das in Bild 6 für das Wasserstoffatom gemacht ist.
| Vor- und Nachteile des bohrschen Atommodells | |
| Das bohrsches Atommodell war ein wichtiger Schritt in der Entwicklung von Vorstellungen über den Aufbau von Atomen. Seine Vorteile, insbesondere gegenüber dem rutherfordschen Atommodell, waren: | |
| Es ermöglichte die Abschätzung des Atomradius. | |
| Es erlaubt die Berechnung der Spektrallinien des Wasserstoffatoms. | |
| Es führte Erkenntnisse der Quantenphysik in die Atomtheorie ein. | |
| Neben diesen Vorteilen gibt es aber auch einige Nachteile, die sich folgendermaßen zusammenfassen lassen: | |
| Es geht von der Existenz definierter Elektronenbahnen aus, die allerdings den Erkenntnisse der Quantenphysik widersprechen, nach denen für Quantenobjekte und damit auch für Elektronen keine Bahnen angegeben werden können. | |
| Das bohrsche Modell erlaubt für Wasserstoff Aussagen, deren Richtigkeit auch experimentell nachweisbar ist. Bei allen anderen Atomen führt es aber zu Ergebnissen, die experimentellen Ergebnissen widersprechen. Es ist also exakt nur für ein Element anwendbar. | |
| Die bohrschen Postulate sind nicht logisch ableitbar; sie erscheinen als willkürliche Annahmen. | |
Eine Weiterentwicklung des bohrschen Atommodells ist das quantenmechanische Atommodell, das in einem gesonderten Beitrag dargestellt ist.
Suche nach passenden Schlagwörtern
- Berechnung
- Quantenmechanisches Atommodell
- Niels Bohr
- Quantentheorie
- rutherfordsches Atommodell
- Termschema
- Bahndrehimpuls
- bohrscher Radius
- Ernest Rutherford
- Hauptquantenzahl
- Spektrallinien des Wasserstoffs
- Atomtheorie
- bohrsche Postulate
- bohrsches Atommodell
- Simulation
- Energieniveauschema
- Rechenbeispiel
- Lichtquantenhypothese
- Photonen
- Serienformel
- Streuversuche