Nebengruppenelemente
Die Nebengruppenelemente einer Periode des PSE unterscheiden sich in ihrer Elektronenkonfiguration nur durch die Besetzung der d-Niveaus. Sie werden deshalb als d-Block-Elemente bezeichnet und ähneln sich in ihren chemischen und physikalischen Eigenschaften weitaus stärker als Hauptgruppenelemente:
| 1. | Alle Nebengruppenelemente sind Metalle. |
| 2. | Sie bilden vielfach farbige, stabile Komplexverbindungen, in denen sie als Elektronenpaarakzeptoren wirken. |
| 3. | Die Elemente der mittleren Gruppen können in vielen verschiedenen Oxidationsstufen auftreten. |
| 4. | Besonders stabil sind Atome oder Ionen, die über halb besetzte oder vollständig besetzte d-Niveaus verfügen. |
Die Nebengruppen sind die Gruppen im Periodensystem, die in der älteren Darstellung (Kurzperiodensystem) neben den entsprechenden Hauptgruppen stehen, und den Einruck erwecken, als wären sie mit diesen „verwandt“. Alle Nebengruppenelemente sind Metalle. So finden wir in dieser Darstellung die Elemente der I. Nebengruppe, die Münzmetalle Kupfer, Silber und Gold, neben der Gruppe der Alkalimetalle, der I. Hauptgruppe.
In einigen Fällen sind gewisse verwandtschaftliche Beziehungen zu erkennen, was besonders bei den Oxidationszahlen sichtbar wird. So bilden die Elemente der I. Nebengruppe wie die Alkalimetalle häufig Verbindungen in denen einfach positiv geladene Kationen vorliegen wie z. B. Silbernitrat und Kupfer(I)-chlorid.
Auch die Elemente der II. Nebengruppe weisen Eigenschaften auf, die denen der Elemente der II. Hauptgruppe, wie Magnesium und Calcium ähnlich sind. Z. B. sind isomorph und bilden Mischkristalle.
Diese Ähnlichkeiten treten auch beim Vergleich in höheren Gruppen auf. So löst sich Chrom(VI)-oxid, wie das in Wasser, zu einer sauren Lösung
Sowohl die Chromate als auch die Sulfate bilden mit Erdalkalimetallionen wie schwerlösliche Verbindungen, während die analogen Magnesiumverbindungen in Wasser gut löslich sind.
Schließlich kann als weiteres Beispiel gelten, dass die bei Normalbedingungen flüssigen und explosiven Verbindungen Dichlorheptoxid, und Dimanganheptoxid, in Wasser die entsprechenden Säuren (Perchlorsäure, Chlor(VII)-säure) bzw. Permangansäure, bilden.
Für die Erklärung der genannten Ähnlichkeiten können wir, wie so oft beim Vergleich chemischer Eigenschaften, die Valenzelektronenkonfiguration heranziehen. Die Alkalimetalle verfügen über ein Valenzelektron, sie haben die Valenzelektronenanordnung (n = 2, 3, 4, 5, 6, 7). Dieses eine Valenzelektron ist mit steigender Hauptquantenzahl n immer weiter vom positiven Kern entfernt. Außerdem wird die positive Kernladung durch die zwischen dem Valenzelektron und dem Kern zu formulierenden abgeschlossenen, also vollständig mit Elektronen besetzten, Energieniveaus, gut abgeschirmt. Das Valenzelektron wird deshalb mit zunehmender Hauptquantenzahl immer leichter abgegeben, die Ionisierungsenergie sinkt.
Bei den Elementen der I. Nebengruppe formulieren wir die Valenzelektronenkonfiguration formal also wieder 1 Valenzelektron, was die Existenz der oben genannten Verbindungen mit (E = Cu, Ag, Au) erklärt. Aber der energetische Unterschied zu den d-Niveaus ist nur gering, so dass auch aus diesen Niveaus Elektronen abgespalten, oder zur Verbindungsbildung genutzt werden können, und Verbindungen wie gebildet werden. Wesentlich ist, dass die Radien der Elemente der 1. Nebengruppe deutlich kleiner sind und damit das s-Valenzelektron fester gebunden ist. Die 1. Ionisierungsenergie der Elemente ist höher, die Metalle sind edler.
Die Valenzelektronenkonfiguration der Elemente der II. Nebengruppe ist und ist damit der Konfiguration der Elemente der II. Hauptgruppe ähnlich. Das erklärt das Auftreten von die einige, den Erdalkalimetallionen ähnliche Eigenschaften haben und auch vergleichbar große Ionenradien aufweisen.
Obwohl wir noch weitere Beispiele für die „Verwandtschaft von Haupt- und Nebengruppen“ finden können, ist ein durchgängiges Prinzip nicht zu erkennen. Stattdessen sind auch deutliche Unterschiede zu erkennen, so z. B. beim Vergleich der Metalle der VII. Nebengruppe mit den stark elektronegativen Nichtmetallen der VII. Hauptgruppe. Zur VIII. Nebengruppe gehören im Kurzperiodensystem sogar 9 Elemente, während bei den anderen Nebengruppen nur 3 Elemente genannt werden.
Deshalb hat sich die Darstellung des Langperiodensystems (Bild 1) durchgesetzt, die das dem PSE innewohnende Aufbauprinzip deutlicher macht. Nach dem Calcium, Elektronenkonfiguration , folgt als nächstes Element das Scandium mit der Valenzelektronenkonfiguration . Das erste d-Block-Element verfügt über insgesamt 3 Valenzelektronen und bildet zusammen mit den Elementen Yttrium, Lanthan und Actinium die 3. Gruppe. Bei ihm sind die 1. bis 3. Ionisierungsenergie vergleichsweise niedrig, so dass gebildet werden können.
-
Periodensystem der Elemente
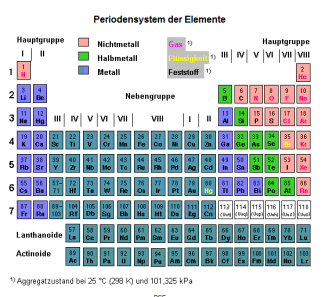
Die Gruppenbezeichnung der d-Block-Elemente kann auch mit arabischen Zahlen von der 3. bis zur 12. Gruppe (Bild 2) erfolgen. Die Nummer der Gruppe ist bei diesem Prinzip identisch mit der Anzahl der Valenzelektronen.
Da insgesamt 10 Elektronen in die d-Orbitale eingebaut werden können, entspricht die Valenzelektronenzahl des Chrom und des Mangan denen von Schwefel bzw. Chlor
Eine für die Nebengruppenelemente charakteristische Eigenschaft, die Farbigkeit ihrer Verbindungen, tritt bei den Elementen auf, die Verbindungen mit Oxidationsstufen bilden, in denen im jeweiligen d-Niveau eine Teilbesetzung vorliegt.
So sind Titan(IV)-Verbindungen farblos, Titan(III)-Verbindungen dagegen violett, weil bei einer Valenzelektronenkonfiguration durch Absorption von Licht in einen angeregten Zustand übergeführt werden kann. Auch Zink(II)-verbindungen sind mit einer Elektronenkonfiguration farblos.
In der folgenden Übersicht sollen die Nebengruppen z. T. tabellarisch vorgestellt werden.
III. Nebengruppe, 3. Gruppe
Die Elemente Scandium, Yttrium, Lanthan und Actinium bilden diese Gruppe. Es sind keine seltenen Metalle, aber sie sind in der Erdkruste fein verteilt. Das bekannteste Mineral ist Thortveitit, Die Metalle sind unedel und ihre Chemie ähnelt der des Aluminiums. Yttriumverbindungen werden als Lumiphore in Farbfernsehröhren genutzt. dient zur Herstellung optischer Gläser.
![]()
-
Periodensystem der Elemente

IV. Nebengruppe, 4. Gruppe
Die Metalle Titan , Zirkonium und Hafnium sind hochschmelzend und korrosionsbeständig und finden Verwendung im Maschinen- und Apparatebau (Bild 3). Die wichtigsten Mineralien sind die Oxide
wird mit Koks und Chlor in übergeführt, das durch Destillation gereinigt und mit Magnesium oder Natrium zum Leichtmetall Titan reduziert wird. Es dominiert die Oxidationszahl IV. Die Verbindungen sind überwiegend kovalent. sind instabil und werden in wässriger Lösung zu umgewandelt. Die Oxide sind hochschmelzende Verbindungen, die als Weißpigment und als hochfeuerfeste Materialien bedeutsam sind. Die Basizität der Oxide nimmt mit steigender Ordnungszahl zu.
Als Folge der Lanthanoidenkontraktion sind die Atomradien von Zirkonium und Hafnium fast gleich und damit die Eigenschaften der Verbindungen sehr ähnlich.
![]()
V. Nebengruppe, 5. Gruppe
Die Elemente Vanadium , Niob und Tantal spielen als Stahlveredler, z. B. für Baustähle eine große Rolle. Tantal ist ein Werkstoff für chirurgische Instrumente und Materialien (Knochennägel, Prothesen). Entsprechend der Elektronenkonfiguration ist die wichtigste Oxidationszahl V. Vanadium ist ein essenzielles Spurenelement und stimuliert die Chlorophyll-Synthese.
Wichtige Quelle für die Synthese von Vanadium und seine Verbindungen ist ein Ti-Fe-Erz, bei dessen Verhüttung in der Schlacke ca. 20% vorliegen. Daraus wird entweder Ferrovanadium, eine V-Fe-Legierung, oder über die thermische Zersetzung von mit dem VAN ARKEL-DE-BOER-Verfahren reines Vanadium gewonnen. Durch Reduktion der Oxide (M = Nb, Ta) mit Kohlenstoff können Niob und Tantal gewonnen werden. Die Metalle reagieren bei höheren Temperaturen mit Nichtmetallen wie Oxidierende Säuren und Alkalihydroxidschmelzen lösen die Metalle.
![]()
VI. Nebengruppe, 6. Gruppe
Die Elemente Chrom , Molybdän und Wolfram sind als Stahlveredler und für den Korrosionsschutz z. B. durch Verchromen von Bedeutung und werden häufig in Form der Eisenlegierungen gewonnen und eingesetzt. Aus dem warmfesten Wolfram werden Glühdrähte und Heizleiter hergestellt.
Während sich Chrom leicht in nichtoxidierenden Säuren löst, sind Molybdän und Wolfram nur in heißen oxidierenden Säuren lösbar. Die chemischen Eigenschaften von Molybdän und Wolfram sind auf Grund der Lanthaniodenkontraktion ähnlich; die Chemie des Chroms (chroma = Farbe) ist wesentlich variabler.
Verbindungen mit niedrigen Oxidationszahlen, also Reduktionsmittel treten als Kationenkomplexe in höheren Oxidationszahlen (Oxidationsmittel) als Anionenkomplexe auf. Die Tendenz zur Bildung von Polyanionen ist groß. Die Acidität der Oxide steigt mit zunehmender Oxidationsstufe.
Chrom ist für den Glucosestoffwechsel und Molybdän in der Atmungskatalyse ein essenzielles Element.
![]()
VII. Nebengruppe, 7. Gruppe
Während Mangan als essenzielles Element zu den häufigsten Elementen der Erdkruste gehört, sind Technetium und Rhenium sehr selten. Die chemischen Eigenschaften von Mangan unterscheiden sich deutlich von denen der schwereren Elemente, die wegen der Lanthanoidenkontraktion ähnliche Eigenschaften aufweisen.
Der saure Charakter der Oxide und die Tendenz zur Bildung anionischer Komplexe steigt mit zunehmender Oxidationszahl.
Als wichtiger Legierungsbestandteil wird Mangan überwiegend als Ferromangan eingesetzt. Mangan ist in der Wärme reaktiv, löst sich in nichtoxidierenden Säuren und überzieht sich an der Luft mit einer dünnen Oxidschicht, die weitere Einwirkung verhindert. Auffällig ist die Vielfarbigkeit von Mn-Verbindungen:
Technetium (griech. technetos = künstlich) wird bei der
Wiederaufbereitung von Kernbrennstäben als gewonnen und isoliert.
Aus den Röstgasen der Molybdän-Produktion wird und daraus Rhenium gewonnen. Es dient zur Herstellung von Thermoelementen und Katalysatoren für bleifreies Benzin.
![]()
VIII. Nebengruppe, 8.–10. Gruppe
Die VIII. Nebengruppe umfasst 9 Elemente. In der Kurzperiodendarstellung stehen diese Elemente neben den Edelgasen (8. Hauptgruppe). Die Reaktionsträgheit der Edelmetalle und die maximale Wertigkeit acht weisen auf diesen formalen Zusammenhang hin. Im Langperoidensystem bilden die Elemente die 8. (Eisen, Ruthenium, Osmium), die 9. (Cobalt, Rhodium, Iridium) und die 10. Gruppe (Nickel, Palladium, Platin) des Periodensystems und werden hier auch getrennt betrachtet.
8.Gruppe
Eisen ist das häufigste Nebengruppenelement der Erdkruste. Es wird aus Oxiden durch Reduktion mit Koks meist in Hochöfen (>10.000t pro Tag und Ofen), teilweise aber auch in Drehrohröfen gewonnen. Aus dem nicht schmiedbaren Roheisen, welches einen hohen Kohlenstoffgehalt aufweist, wird schmiedbarer Stahl mit einem Kohlenstoffanteil < 2,1%, hergestellt. Über 1800 verschiedene Stahlsorten sind bekannt.
Eisen ist ein wichtiges Biometall (Hämoglobin, Ferredoxine) und mit ca. 4 g in jedem Menschen enthalten.
![]()
9. Gruppe
Cobalt ähnelt in seinen chemischen und physikalischen Eigenschaften dem Eisen. Es ist ein Permanentmagnet und wichtiges Legierungsmetall für hochwarmfeste Werkstoffe. In Verbindungen tritt es als zweifach oder dreifach geladenes Kation auf.
Iridium und Rhodium sind chemisch besonders resistent. Iridium ist das dichteste chemische Element.
![]()
10. Gruppe
Nickel ist in seinen Eigenschaften (Ferromagnetismus, Ionenwertigkeit) den Elementen Cobalt und Eisen ähnlicher als den schwereren Elementen der 10. Gruppe. Es ist allerdings im Gegensatz zu Eisen luftbeständig. Nickel wird in Speziallegierungen (Monel; Cu-Ni-Legierung) und vielen Katalysatoren, speziell für Hydrierungen verwendet. Auch Platin, Palladium und Rhodium finden Verwendung als Katalysatoren (Autoabgaskatalysator /Pt, katalytische Oxidation von Ammoniak / Rh, katalytische Hydrierung /Pd) und wegen der chemischen Beständigkeit als Kontaktmetalle in der Elektrotechnik bedeutsam. Ein cm³ Palladium ist in der Lage unter Aufweitung des Gitters 350 cm³ Wasserstoff, aufzunehmen.
![]()
I. Nebengruppe, 11. Gruppe
In dieser Gruppe sind die seit dem Altertum bekannten sogenannten Münzmetalle , das technisch bedeutsame Kupfer und die beiden Edelmetalle Silber und Gold enthalten. Sie kommen als Sulfide () oder auch gediegen (Au) in der Natur vor. Der Anteil der Wiederaufarbeitung ist sehr hoch.
Wegen der Korrosionsbeständigkeit wird Gold für Kontakte in der Elektronik verwendet. Kupfer ist ein bedeutsames Metall der Bauindustrie (Rohre, Rinnen, Dächer) und ein wichtiges Legie-rungsmetall (Bronzen, Messing). Silberhalogenide spielen in der Fotografie eine wichtige Rolle.
![]()
2. Nebengruppe, 12. Gruppe
Dazu gehören die Elemente Zink , Cadmium und das einzige bei Raumtemperatur flüssige Metall Quecksilber. Wie für die Nebengruppen charakteristisch, nimmt der edle Charakter mit steigender Ordnungszahl zu.
Durch Verzinken werden Stahl und Eisen wirkungsvoll vor Korrosion duirch Rosten geschützt. Zink ist in über 200 Enzymen enthalten.
Die drei Metalle kommen in der Natur häufig als Sulfide vor.
Cadmium- und Quecksilberverbindungen sind im Gegensatz zu den Zinkverbindungen toxisch, die Metalle werden an schwefelhaltigen Spezies fixiert. Quecksilber wird vor allem bei der Chloralkalielektrolyse als Katodenmetall verwendet.
![]()
Suche nach passenden Schlagwörtern
- Cadmium
- d-Block-Elemente Kupfer
- Zink
- Iridium
- Nebengruppen
- Ruthenium
- Silber
- Vanadium
- Mangan
- Ähnlichkeiten
- Technetium
- Osmium
- d-Elemente
- Yttrium
- Chrom
- Molybdän
- Quecksilber
- WOLFRAM
- Valenzelektronenkonfiguration
- Rhodium
- PSE
- Katalysatoren
- Scandium
- Palladium
- Titan
- Gold
- Farbigkeit
- Münzmetalle
- Hafnium
- Niob
- Nickel
- Eisen
- Tantal
- Cobalt
- Platin
- Zirkonium
- Rhenium

