Neutralisationsreaktionen in Natur und Technik
Neutralisationsreaktionen sind spezielle Reaktionen zwischen Säuren und Basen, bei denen äquivalente Stoffmengen der Basen und Säuren miteinander reagieren. Bei dieser exothermen Reaktion heben sich die Wirkung der Säure und Base gegenseitig auf und man erhält in der Regel eine neutrale Lösung mit dem pH-Wert von 7. Dieser Fakt wird in der Technik, in der Medizin bzw. auch in der Landwirtschaft häufig bewusst ausgenutzt, spielt aber auch in der oft in der Natur eine Rolle.
Bei Neutralisationsreaktionen reagieren Säuren und Basen miteinander. Dabei bilden sich aus den Wasserstoff-Ionen (Hydronium-Ionen) der Säuren und den Hydroxid-Ionen der Basen Wassermoleküle.
Neutralisationsreaktionen nach BRÖNSTED:
Die wesentliche Reaktion ist immer die Bildung der Wassermoleküle aus den Hydronium- und Hydroxid-Ionen. Deshalb wird bei allen Neutralisationsreaktionen die gleiche Wärmemenge von 57 kJ pro mol frei.
Setzt man äquivalente Stoffmengen der Basen und Säuren bei der Reaktion ein, erhält man den eine neutrale Lösung mit dem pH-Wert von 7. Dieser Fakt wird in der Technik, in der Medizin bzw. auch in der Landwirtschaft häufig bewusst ausgenutzt, spielt aber auch in der oft in der Natur eine Rolle.
Antazida
Antazida sind Arzneimittel, die gegen „Sodbrennen“ eingesetzt werden. Sodbrennen kommt u. a. zustande, wenn die Säureproduktion im Magen zu stark ist. Wenn der Verschlussmechanismus des Magens nicht richtig funktioniert, gelangt die Magensäure in die Speiseröhre. Das saure Aufstoßen und das brennende Gefühl sind nicht nur unangenehm, sondern kann auch zu Entzündungen der Speiseröhre führen. Die Ursache kann in der Lebensweise bestehen, beispielsweise kann diese Überproduktion durch Stress oder auch falsche Ernährung ausgelöst werden (Bild 1). Zur Bekämpfung der Symptome können Antazida eingesetzt werden.
Name des Medikaments (Beispiele) |
|
| Bullrich-Salz® | Natriumhydrogencarbonat |
| Kompensan® | Aluminiumnatriumcarbonatdihydroxid |
| Talcid® | Hydrotalcid (Aluminiummagnesium-hydroxidcarbonathydrat) |
| Maloxan® | Aluminiumhydroxidgel, Magnesiumhydroxidgel |
| Aludrox® | Aluminiumhydroxid |
| Rennie® | Calciumcarbonat, Magnesiumcarbonat |
Alle Wirkstoffe der verschiedenen Arzneimittel reagieren mit Wasser basisch. Durch ihre Reaktion mit der Salzsäure wird die Konzentration der Wasserstoff-Ionen (Hydronium-Ionen) vermindert.
Reaktionen nach BRÖNSTED:
-
Stress und ungesunde Lebensweise können zu Sodbrennen führen.

Heinz Mahler, Berlin
Auch das alte Hausmittel, bei Sodbrennen einen Löffel Natron in Wasser aufzulösen, führt natürlich zur Neutralisation der Säure und hilft somit gegen den niedrigen pH-Wert (siehe zweite Beispielreaktion). Sieht man sich aber die Reaktionsgleichung genauer an, bemerkt man, dass als Reaktionsprodukt Kohlenstoffdioxid entsteht. Das Gas wiederum kann zu einem unangenehmen Völlegefühl führen, sodass Omas Hausmittel zwar wirkt, aber nicht das Mittel der ersten Wahl sein sollte.
Neutralisationsraktionen im Boden
Überprüft man den pH-Wert von Böden mit einer guten Krümelstruktur, stellt man meist Werte fest, die im neutralen oder im leicht basischen Bereich liegen. Saurer Regen beeinflusst diesen pH-Wert in bestimtem Maße (Bild 2). Überprüft man die Veränderungen des pH-Wertes bei Zugabe von sauren Lösungen zu Bodenproben, stellt man allerdings fest, dass der pH-Wert bis zu einer bestimmten Säuremenge fast konstant bleibt. Ganz einfach ist dieses unerwartete Ergebnis nicht zu erklären. Zuerst einmal denkt man natürlich an eine einfache Neutralisationsreaktion, die im Boden abläuft. Dabei würden sich die Hydroxid-Ionen und die Wasserstoff-Ionen (Hydronium-Ionen) zu Wassermolekülen verbinden. Dann müsste sich der pH-Wert aber schneller ändern. Da das nicht passiert, spricht man von der Pufferwirkung des Bodens.
Diese Wirkung beruht im pH-Bereich von 6,2-8,3 auf einem Kohlensäure-Hydrogencarbonat-System. Im Boden ist Kohlensäure enthalten. Sie gelangt durch die Reaktion von Kohlenstoffdioxid mit Wasser hinein. Die Kohlensäure reagiert mit Wasser. Dabei bilden sich Hydrogencarbonationen.
Reaktion nach BRÖNSTED:
In der Natur läuft diese Reaktion ständig ab. Gleichzeitig bildet sich aber aus den entstandenen Reaktionsprodukten ständig wieder der Ausgangsstoff. So entsteht ein Gleichgewicht, in dem immer ein bestimmtes Verhältnis zwischen dem Ausgangsstoff (Kohlensäure) und den Reaktionsprodukten (Hydrogencarbonat-Ionen und Wasserstoff-Ionen) vorliegt.
Durch dieses Puffersystem werden neu hinzukommende Wasserstoff-Ionen (Hydronium-Ionen), beispielsweise aus dem sauren Regen, praktisch „weggefangen“. Die Hydrogencarbonat-Ionen reagieren mit den „neuen“ Wasserstoff-Ionen (Hydronium-Ionen) zu undissoziierter Säure. Die Wasseratome als Bestandteil der Säuremoleküle beeinflussen den pH-Wert der Lösung nicht. Kommen jedoch zu viele Wasserstoff-Ionen (Hydronium-Ionen) hinzu, funktioniert dieses Puffersystem nicht mehr. Dann fällt der pH-Wert relativ stark ab.
Das Besondere an Puffersystemen ist, dass nicht nur Wasserstoff-Ionen (Hydronium-Ionen), sondern auch Hydroxid-Ionen in gewissem Maße abgepuffert werden. Hydroxid-Ionen reagieren mit der undissozierten Säure und bilden dabei Salze und Wasser. Dadurch wird der pH-Wert ebenfalls kaum beeinflusst.
Das Puffersystem aus Kohlensäure und Hydrogencarbonat-Ionen spielt bei natürlichen Vorgängen häufig eine große Rolle. Für biochemische Prozesse ist es oft wichtig, dass ein konstanter pH-Wert eingehalten wird. Dies ist u. a. in der Mundhöhle der Fall. Speichel enthält ebenfalls die genannten Ionen. Dadurch können durch eine gute Speichelproduktion Säuren in der Mundhöhle abgepuffert werden. Aber auch im Blut wird der pH-Wert unter anderem durch dieses Puffersystem konstant gehalten.
Sinkt der pH-Wert des Bodens durch sauren Regen oder durch Austauschvorgänge zwischen Pflanzen und Boden zu stark ab, werden die Pflanzen nicht nur direkt beeinträchtigt, sondern es erfolgt auch eine Mineralstoffauswaschung. Außerdem werden an die Bodenteilchen gebundene Schwermetall-Ionen freigesetzt, die eine zusätzliche Belastung für die Pflanzen darstellen. Nur wenige Spezialisten ertragen pH-Werte im sauren Bereich. Die meisten Nutzpflanzen benötigen neutralen bzw. sogar leicht basischen Boden. Daher wird neben anderen Werten der pH-Wert des Bodens genau überprüft. Gegebenenfalls muss durch Düngung der pH-Wert erhöht werden. Dabei nutzt man Neutralisationsreaktionen aus.
Beispielsweise ist der Einsatz von Magnesiumoxid möglich, um saure Böden zu neutralisieren (Reaktion nach BRÖNSTED):
Ähnlich reagiert Calciumoxid. Durch die Verringerung der Konzentration der Wasserstoff-Ionen (Hydronium-Ionen) steigt der pH-Wert.
Die beschriebenen chemischen Vorgänge bewirken eine sehr schnelle Änderung des pH-Wertes und können deshalb nicht überall zum Einsatz kommen. Mit dem Einsatz von Calciumcarbonat oder Magnesiumcarbonat kann man ebenfalls den pH-Wert beeinflussen. Die Wirkung erfolgt jedoch langsamer, dafür umso schonender. Sie beruht darauf, dass infolge der Reaktionen im Boden wiederum der Anteil an Hydrogencarbonat-Ionen erhöht wird und die oben beschriebenen Prozesse ablaufen.
Im Übrigen wird durch die Gabe von Kalk nicht nur der Ackerboden behandelt. Man versucht auch, durch die Düngung der Wälder mit calciumcarbonathaltigen Düngemitteln die Folgen des sauren Regens zu vermindern.
Kaugummi kontra Säuren?
Mit der Nahrung nehmen wir erstaunlicherweise viele säurehaltige Nahrungsmittel zu uns. Dazu gehört selbst Mineralwasser und viele Süßigkeiten. Außerdem bilden sich in Zahnbelägen (Plaque) unter dem Einfluss von Bakterien aus Zucker ebenfalls Säuren.
Die Säuren greifen den Zahnschmelz an, unter einem pH-Wert von 5,7 erfolgt die Demineralisierung, das heißt die Calcium-Ionen werden aus den Zähnen gelöst. Infolge der bakteriellen Tätigkeit im Plaque kann der pH-Wert auf 3,5 sinken.
Vor nicht allzu langer Zeit wurde daher geraten, nach jedem Essen sofort die Zähne gründlich mit einer Zahnbürste zu reinigen. Nach neuesten Erkenntnissen ist diese Hygienevorschrift aber überholt. Gerade weil die Säuren (die mit der Nahrung aufgenommen werden) den Zahnschmelz angreifen, soll man die Zähne in dieser Phase möglichst nicht mit der Bürste bearbeiten, denn dadurch werden Schäden am Zahn hervorgerufen. Das Milieu in der Mundhöhle muss sich erst wieder normalisieren, sodass der Schmelz wieder härten kann. Dann müssen die Zähne natürlich gereinigt werden, um die Ausbildung von Plaque zu verhindern.
Direkt nach einer Mahlzeit bzw. wenn man säurehaltige Lebensmittel wie Obstsäfte zu sich genommen hat, kann man die Herstellung des normalen Milieus unterstützen. Empfohlen wird, den Mund mit Wasser auszuspülen. Durch das Wasser wird die Konzentration der Säuren im Mund einfach verdünnt und Essensreste werden fortgespült.
Man kann aber auch (zuckerfreien) Kaugummi kauen, dabei muss es sich eigentlich nicht einmal um einen sogenannten Zahnpflegekaugummi handeln. Der wesentliche Bestandteil der Kaugummis ist die Kaumasse, die oft aus Kautschuk besteht. Wichtig ist für die Zahngesundheit natürlich, dass keine Saccharose, Fructose oder Glucose enthalten sind, die man beim Kauen noch besonders mit dem Zahn in Berührung bringt. Die positive Wirkung des Kaugummis für die Zahngesundheit beruht darauf, dass durch das Kauen der Speichelfluss angeregt wird. Speichel hat zwar einen pH-Wert von ca. 6,5 (und ist somit nicht basisch), er enthält aber Ionen, die Säuren „puffern“. Hauptsächlich handelt es sich um Hydrogencarbonat-Ionen. So laufen Neutralisationsreaktionen ab, bei denen die Anzahl der Wasserstoff-Ionen (Hydronium-Ionen) verringert wird (siehe Neutralisationsreaktionen im Boden). So steigt der pH-Wert bis fast in den neutralen Bereich.
Neutralisation von Abwässern
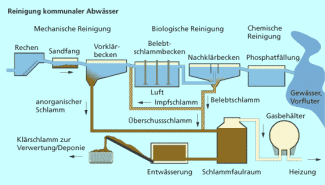
Abwässer aus Haushalten sind häufig nicht neutral. Sie enthalten Säuren aus Badreinigern, Säuren aus Lebensmitteln, basischen Seifenlösungen oder basische Rohrreiniger u. a. Auch die Abwässer aus der Industrie liegen sind selten pH-neutral. Hinzu kommen saure Lösungen aus der Regenentwässerung, wenn der pH-Wert durch Reaktionen mit Industrieabgasen im sauren Bereich liegt. Alle dies Abwässer gelangen in Klärwerke, denn sie müssen gereinigt werden, ehe sie wieder in Oberflächengewässer eingeleitet werden können.
Im Klärwerk wird das Wasser nicht nur mechanisch, sondern auch mithilfe von Mikroorganismen gereinigt. (In vielen Klärwerken erfolgt zudem noch eine chemische Phosphat- und Nitratfällung, siehe Bild 5). Die Mirkoorganismen bauen gelöst vorliegende Verunreinigung ab. Das erfolgt in sogenannten Belebungsbecken. Für die biochemischen Reaktionen wird Sauerstoff benötigt, der in diese speziellen Becken durch ein Belüftungssystem realisiert wird. Die Mirkoorganismen vertragen keine großen Schwankungen des pH-Wertes. Sie benötigen ein neutrales Milieu. Daher wird der pH-Wert der Abwässer geprüft und die Lösungen mit Säuren oder Basen behandelt, um sie zu neutralisieren. Ist das Abwasser sauer, wird Natriumhydroxid eingesetzt (Reaktion nach BRÖNSTED):
Zu basischen Abwässern wird Säure hinzugefügt. Auch hier erfolgt eine Neutralisation durch die Reaktion der Wasserstoff-Ionen (Hydronium-Ionen) mit den Hydroxid-Ionen zu Wasser.
Neutralisation nach BRÖNSTED:
-
Auch in kommunalen Klärwerken spielen Neutralisationsreaktionen eine wichtige Rolle.
Neutralisationsreaktionen zur Maßanalyse
Die Säure-Base-Titrationen (Neutralisationstitrationen) dienen zur Bestimmung von Konzentrationen von Säure- bzw. Baselösungen. Dabei wird ausgenutzt, dass die Wasserstoff-Ionen (Hydronium-Ionen) der Säurelösung mit den Hydroxid-Ionen der Baselösung zu Wassermolekülen reagieren und sich entsprechend der pH-Wert der Lösung ändert. Am Äquivalenzpunkt sind die Mengen der Säure und der Base exakt gleich. Man bestimmt diesen Punkt, indem zu einer Analysenlösung mit einem bekannten Volumen, aber unbekannter Konzentration eine Maßlösung mit einer bekannten Konzentration hinzufügt. Mithilfe eines geeigneten Indikators kann man der Punkt erkennen, an dem sich die Säure und die Base in ihrer Wirkung aufheben, also weder ein Überschuss an Wasserstoff-Ionen noch an Hydroxid-Ionen vorliegt. Mithilfe der ermittelten Messwerte kann die Konzentration der Analysenlösung berechnet werden (Rechenbeispiel).
Der Ablauf von Säure-Base-Titrationen ist in einem anderen Beitrag auf dieser CD beschrieben. Diese maßanalytischen Titrationsverfahren kommen vielfältig zum Einsatz: für die Überwachung von Umweltprozessen, wie die Analyse der Wasser- und Bodenqualität, für die Prozessführung bei der Herstellung von Lebens- und Arzneimitteln, bei der Aufdeckung von Umweltskandalen usw.

