Stabilität von Komplexen
Die Stabilität von Komplexverbindungen hat sowohl thermodynamische als auch kinetische Ursachen. Die Stärke der Donor-Akzeptor-Wechselwirkung zwischen Zentralion und Liganden und somit die Stärke der koordinativen Bindung hängt von der Lewis-Acidität des Zentralions und der Lewis-Basizität der Liganden ab. Quantitativ kann die thermodynamische Stabilität mithilfe des Massenwirkungsgesetzes bestimmt werden.
Die Stabilität von Komplexverbindungen nutzt man in der chemischen Analyse z. B. zum Auflösen von Niederschlägen aus Fällungsreaktionen oder zur Maskierung von bestimmten Ionen in Lösung.
Komplexe entstehen, wenn mehrere Liganden – meist zwei, vier oder sechs – über koordinative Bindungen an ein Metallatom oder Metallion gebunden werden. Die Eigenschaften eines Komplexes unterscheiden sich von den Eigenschaften seiner Einzelbestandteile (Zentralteilchen und Liganden), so bleiben z. B. typische Reaktionen wie Fällungs- oder Redoxreaktionen aus, wenn die entsprechenden Ionen fest in einem Komplex gebunden sind. Wie fest die Bindungen in einem Komplex sind, und in welchem Maße demzufolge Reaktionen der einzelnen Komplexbestandteile auftreten können, wird im wesentlichen durch die thermodynamische Stabilität des Komplexes bestimmt, die mithilfe des Massenwirkungsgesetzes angegeben werden kann.
Komplexbildungskonstante und Dissoziationskonstante
Die Anlagerung der Liganden an das Zentralteilchen ist eine Gleichgewichtsreaktion, es gilt daher das Massenwirkungsgesetz . Die Gleichgewichtskonstante für die Bildung von Komplexen wird als Komplexbildungskonstante bezeichnet, ihr Kehrwert, der die Dissoziation von Komplexen beschreibt, als Dissoziationskonstante .
Die Bildung des Tetracyanonickelat(II)-Komplexes in wässriger Lösung lässt sich durch folgende Reaktionen beschreiben:
Die Komplexbildungskonstante errechnet sich aus dem Massenwirkungsgesetz für die Gesamtreaktion:
Die Komplexdissoziation stellt die Umkehrung der Komplexbildung dar, dementsprechend ist die Dissoziationskonstante der Kehrwert der Komplexbildungskonstante .
Da eine stufenweise Anlagerung bzw. Dissoziation der Liganden möglich ist, ist es sinnvoll, individuelle Bildungskonstanten für die einzelnen Teilreaktionen zu bestimmen. Für den Tetracyanonickelat(II)-Komplex lassen sich vier voneinander unterschiedliche Bildungskonstanten berechnen. Aus dem Produkt dieser Bildungskonstanten ergibt sich die Brutto-Bildungskonstante .
Komplexe, die in wässriger Lösung kaum dissoziieren, haben eine große Komplexbildungskonstante. Sie werden starke Komplexe genannt. Schwache Komplexe haben eine kleinere Komplexbildungskonstante, sie dissoziieren in wässriger Lösung teilweise, d. h. der Ligand liegt teilweise frei vor und kann deshalb chemisch nachgewiesen werden. Die Dissoziationskonstante ist bei starken Komplexen dementsprechend klein, bei schwachen Komplexen groß (Bild 2).
Welche Komplexe sind stabil?
Thermodynamische Stabilität
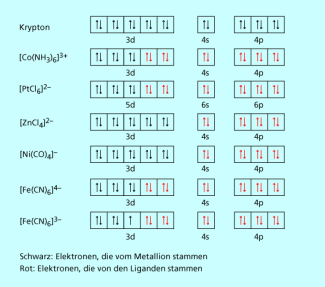
Thermodynamisch besonders stabil sind in der Regel diejenigen Komplexe, deren Zentralionen durch die Elektronen der Liganden eine Edelgaskonfiguration erhalten. Diese entspricht bei den Nebengruppenmetallen der allgemeinen Elektronenkonfiguration insgesamt also 18 Elektronen, weshalb die entsprechende Regel 18-Elektronen-Regel genannt wird. Sie gilt z. B. für die Komplexe (Bild 3).
Außerdem hängt die thermodynamische Stabilität stark von der Lewis-Basizität des Liganden ab. Besonders stabile koordinative Bindungen werden von Liganden ausgebildet, deren freies Elektronenpaar an einem Atom mit niedriger Elektronegativität sitzt oder/und die negativ geladen sind. So sind Amminkomplexe stabiler als Aquakomplexe, weil Sauerstoff elektronegativer als Stickstoff ist, und Cyanokomplexe wiederum stabiler als Amminkomplexe, weil Cyanidionen eine negative Ladung besitzen, die sich außerdem am Kohlenstoffatom befindet
Kinetische Stabilität
Die kinetische Stabilität von Komplexen – also die Geschwindigkeit von Ligandenaustauschreaktionen – hängt von der Koordinationszahl des Zentralions,von Größe und Art der Liganden und von der Änderung der Ligandenfeldstabilisierungsenergie mit der Geometrieänderung im Übergangszustand ab. Die Geschwindigkeit der Ligandenaustauschreaktion eines beliebigen Liganden X nach dem Prinzip
kann man beispielsweise mithilfe von radioaktiv markierten Liganden X* ermitteln, die der wässrigen Lösung zugesetzt werden.
Kinetisch besonders stabil sind oktaedrische Komplexe mit großen Liganden, Hexacyanoferrat(II) (Bild 4). Durch die sechsfache Koordination und die Größe der Liganden ist das Zentralion räumlich hervorragend vor dem Angriff anderer Liganden abgeschirmt, sodass ein Ligandenaustausch, auch wenn er thermodynamisch (also energetisch) begünstigt ist, nur sehr langsam ablaufen kann.
Kinetisch stabil sind auch Chelatkomplexe, weil sie erstens über voluminöse Liganden verfügen und zweitens mehrere Bindungen des Liganden zum Zentralion gleichzeitig gelöst werden müssen, damit Komplexdissoziation stattfindet und ein Ligandenaustausch möglich wird.
Ein thermodynamisch stabiler Komplex muss aber nicht auch kinetisch stabil sein und umgekehrt, wie die folgenden Beispiele zeigen.
Der Komplex [Co(NH3)6]3+ ist thermodynamisch für die Reaktion
mit einer Gleichgewichtskonstanten von etwa 1025 sehr instabil. Bei Raumtemperatur erfolgt aber in der sauren wässrigen Lösung kein Austausch, er ist kinetisch sehr stabil.
Der Nickel(II)-Tetracyanokomplex dagegen tauscht mit isotopenmarkiertem Cyanid in Lösung sehr schnell Cyanid-Ionen aus, er ist kinetisch instabil. Die thermodynamische Stabilität ist aber sehr groß. Die Gleichgewichtskonstante für die angegebene Reaktion mit Wasser beträgt 10-22.
Wettbewerb zwischen Fällungsreaktionen und Komplexbildung
Die hohe thermodynamische Stabilität von Komplexen nutzt man auf verschiedene Weise in der chemischen Analytik.
So kann man durch Zugabe von Komplexbildnern die Fällung schwer löslicher Salze verhindern oder gefällte Niederschläge wie z. B. Silberchlorid wieder auflösen (Bild 5).
Um zu verstehen, warum sich manche schwer lösliche Salze durch Komplexbildung auflösen und andere nicht, muss man die Komplexbildungskonstante des entstehenden Komplexes und das Löslichkeitsprodukt des schwer löslichen Salzes miteinander vergleichen.
Zur Veranschaulichung soll das Beispiel Silberchlorid dienen: Gibt man eine Lösung, die Silber-Ionen enthält, zu einer chloridhaltigen Lösung, so fällt schwer lösliches Silberchlorid aus:
Gibt man nun Ammoniakwasser hinzu, so löst sich der Niederschlag allmählich auf, weil der wasserlösliche Diamminsilber(I)-Komplex gebildet wird.
Aus dem Löslichkeitsprodukt von Silberchlorid lässt sich ableiten, dass die Konzentration von Silber-Ionen in einer gesättigten Silberchlorid-Lösung beträgt. Bei Zugabe von Ammoniak wird durch die Bildung des stabileren Diammin-Komplexes die Konzentration an freien Silber-Ionen in der Lösung verringert. Dadurch wird das Löslichkeitsprodukt von Silberchlorid unterschritten, d. h. das Produkt aus Silber-Ionen und Chlorid-Ionen wird kleiner als . Um diesen Wert wieder zu erreichen löst sich vorhandenes Silberchlorid auf, was wiederum die Bildung von weiterem Diamminsilber(I) ermöglicht, bis allmählich der gesamte Niederschlag gelöst ist.
Berechnung
Dies lässt sich folgendermaßen berechnen: Die Konzentration des gelösten Silberchlorids entspricht der Konzentration der in Lösung befindlichen Chlorid-Ionen Insgesamt haben sich ebenso viele Silber-Ionen wie Chlorid-Ionen gelöst, von denen jedoch ein Teil zum Diamminsilber(I)-Komplex reagiert hat.
(1)
Da die Komplexbildungskonstante mit relativ groß ist, liegen kaum Silber-Ionen, sondern fast ausschließlich Komplex-Ionen in der Lösung vor
Gleichung (1) lässt sich also vereinfachen zu:
(2)
-

Heinz Mahler, Berlin
Setzt man dies in das Massenwirkungsgesetz für die Komplexbildung ein, so erhält man:
(3)
Die Verknüpfung von Komplexbildungskonstante und Löslichkeitsprodukt lässt sich herstellen, indem man in Gleichung (3) durch folgenden Ausdruck ersetzt, der sich aus dem Löslichkeitsprodukt ableiten lässt:
(4)
Eingesetzt in Gleichung (3) ergibt sich somit:
und somit:
Für das besprochene Beispiel wäre also:
Die Löslichkeit eines schwer löslichen Salzes ergibt sich also aus dem Verhältnis der Komplexbildungskonstante und des Löslichkeitsproduktes sowie der Konzentration des hinzugegebenen Komplexbildners in der Lösung.
Beim Silberchlorid ist das Produkt der Gleichgewichtskonstanten so groß, dass schon kleine Ammoniak-Konzentrationen genügen, um den Niederschlag aufzulösen.
Silberiodid hingegen ist so schwer löslich, dass es durch Ammoniak-Zugabe nicht aufgelöst werden kann. Gibt man zu einem Silberiodid-Niederschlag aber Cyanid-Ionen, so löst er sich auf, weil der sehr stabile Dicyanoargentat(I)-Komplex gebildet wird
Fazit:
| Die Auflösung eines schwer löslichen Salzes findet umso eher statt | |
| Je stabiler der gebildete Komplex ist, d. h. je größer seine Komplexbildungskonstante ist | |
| Je besser sich das Salz löst, d. h. je größer sein Löslichkeitsprodukt ist | |
| Je höher die Konzentration des Komplexbildners ist | |
Das Rechenbeispiel verdeutlicht, wie in Abhängigkeit von den speziellen Reaktionsgleichungen und Gleichgewichtskonstanten die Löslichkeiten vieler schwer löslicher Salze in Gegenwart unterschiedlicher Komplexbildner berechnet werden können.
Maskierung
Von Maskierung spricht man, wenn bestimmte Ionen durch Komplexbildung vor anderen Teilchen, mit denen sie reagieren würden „versteckt“ werden. Hierbei wird die Stabilität von Komplexen also genutzt, um bestimmte Reaktionen von Ionen gar nicht erst stattfinden zu lassen.
So kann man die Fällung von Silber-Ionen durch Chlorid-, Bromid- oder Iodid-Ionen verhindern, indem man vorher Cyanid-Ionen in die Lösung gibt. Die vorhandenen Silber-Ionen werden durch ihre „Verkleidung“ als Dicyanoargentat(I)-Komplex für die Halogenid-Ionen „unsichtbar“ und reagieren daher nicht mit ihnen.
Die Maskierung stellt sozusagen den umgekehrten Fall des Auflösens von Niederschlägen dar.
Ein weiteres Beispiel ist die Reaktion
Die Bildung des intensiv roten Eisenthiocyanat-Komplexes unterbleibt bei Anwesenheit von Fluorid-Ionen in der Lösung. Die Eisen(III)-Ionen werden dann durch die Bildung des stabilen farblosen FeF6 3--Komplexes maskiert.