Thermodynamische Ableitung des Massenwirkungsgesetzes
Die Gleichgewichtskonstante ist eine thermodynamische Größe, die sich aus den energetischen Unterschieden zwischen Ausgangsstoffen und Reaktionsprodukten ergibt. Aus der thermodynamischen Ableitung der Gleichgewichtskonstanten K erhält man folgenden quantitativen Zusammenhang:
Die Berechnung der Gleichgewichtskonstanten aus der freien Standardreaktionsenthalpie ist viel einfacher als die experimentelle Bestimmung aller Konzentrationen im chemischen Gleichgewicht.
Die Tatsache, dass man das Massenwirkungsgesetz aus kinetischen Betrachtungen ableiten kann, soll nicht darüber hinwegtäuschen, dass die Gleichgewichtskonstante eine thermodynamische Größe ist.
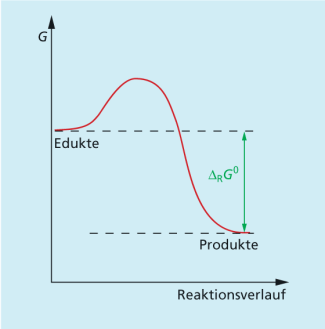
In welchem Verhältnis Edukte und Produkte im Gleichgewicht vorliegen, hängt davon ab, wie groß der Energiegewinn durch die Änderung der freien Standardreaktionsenthalpie ist. Je stärker negativ ist, um so vollständiger ist der Stoffumsatz von Edukten zu Produkten.
Um den quantitativen Zusammenhang zwischen der Gleichgewichtskonstanten und der freien Standardreaktionsenthalpie abzuleiten, muss man den Unterschied zwischen freier Reaktionsenthalpie und freier Standardreaktionsenthalpie betrachten. Eine chemische Reaktion verläuft freiwillig immer in die Richtung, in der die freie Reaktionsenthalpie abnimmt. Im Gleichgewichtszustand ist makroskopisch weder die Hinreaktion noch die Rückreaktion zu beaobachten, d. h. (nicht !!!) muss gleich Null sein.
Die freie Reaktionsenthalpie kann auch durch folgende Gleichung berechnet werden:
Im Gleichgewichtzustand gilt:
Daraus ergibt sich folgender Zusammenhang zwischen der freien Standardreaktionsenthalpie und der Gleichgewichtskonstanten:
Anhand des Betrages von kann man relativ einfach voraussagen, auf welcher Seite das chemische Gleichgewicht liegt:
| 1. | < 0, d. h. K > 1 und der Anteil der Produkte im Gleichgewicht ist höher als der Anteil der Edukte. |
| 2. | > 0, d. h. K < 1 und der Anteil der Produkte im Gleichgewicht ist kleiner als der Anteil der Edukte. |
Mithilfe der freien Standardreaktionsenthalpie kann die Gleichgewichtskonstante und damit die maximal mögliche Ausbeute einer chemischen Reaktion in einem geschlossenen System bei einer bestimmten Temperatur quantitativ berechnet werden. Dieses Verfahren ist viel einfacher als die experimentelle Bestimmung von Gleichgewichtskonstanten. Bei technischen Prozessen wie der Synthese von Ammoniak oder Laborsynthesen wie der Chlorierung von Alkanen kann man auf diese Weise voraussagen, welche Ausbeuten unter bestimmten Reaktionsbedingungen maximal zu erwarten sind.