Titration von Säuren und Basen
Die quantitative Säure-Base-Titration ist eine wichtige Analysemethode im chemischen Labor, im Bereich der Umweltüberwachung und der chemischen Industrie. Sie kann sowohl zur Bestimmung der Konzentration starker als auch schwacher Säuren bzw. Basen eingesetzt werden. Dabei muss allerdings der unterschiedliche Verlauf der Titrationskurven beachtet werden. Dieser Verlauf ist u. a. wichtig für die Auswahl eines geeigneten Farbstoffs als Säure-Base-Indikator. Der Äquivalenzpunkt einer Säure-Base-Titration kann auch potenziometrisch oder konduktometrisch bestimmt werden.
Neutralisationsreaktionen lassen sich quantitativ genau verfolgen, indem pH-Diagramme, sogenannte Neutralisationskurven, bei Säure-Base-Titrationen aufgenommen werden.
Außerdem ist die Säure-Base-Titration eine einfache und sehr genaue Methode zur Bestimmung der Konzentration einer Säure bzw. Base. Sie beruht auf der pH-Änderung der zu untersuchenden Lösung bei schrittweiser Zugabe einer Säure bzw. Base genau bekannter Konzentration, die Maßlösung genannt wird. Trägt man die pH-Werte gegen das Volumen an zugesetzter Maßlösung auf, erhält man die Titrationskurve. Der Verlauf der Titrationskurve hängt davon ab, ob man die Konzentration einer starken Säure bzw. Base oder die Konzentration einer schwachen Säure bzw. Base bestimmen will.
Titration einer starken Säure mit einer starken Base
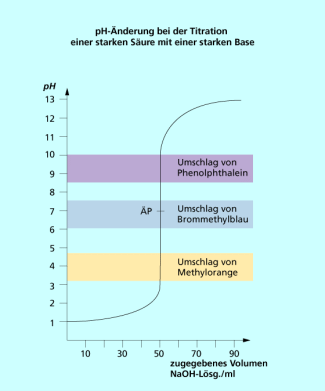
Wird eine starke Säure unbekannter Konzentration mit einer starken Base bekannter Konzentration titriert, so werden die zunächst im Überschuss vorliegenden Oxonium-Ionen die mit der Maßlösung zugegebenen Hydroxid-Ionen unter Bildung von Wassermolekülen vollständig protolysieren. Da hierbei die Konzentration an abnimmt, steigt der pH-Wert an.
Wegen der logarithmischen Beziehung zwischen pH und ist die pH-Änderung zunächst sehr gering. Wenn 90 % der ursprünglichen Säure neutralisiert sind, hat sich die gerade auf 1/10 des ursprünglichen Wertes geändert. Die Verringerung der Konzentration um den Faktor 10 führt zu einer pH-Änderung um eine Einheit.
Bei 99 %-iger Neutralisation der Säure hat der pH-Wert um eine weitere Einheit abgenommen. Bei 99,9 % neutralisierter Säure ist der pH-Wert wiederum um eine weitere Einheit gestiegen usw. (Bild 2).
Der Punkt, an dem die Stoffmenge an zugegebener Maßlösung exakt der Stoffmenge an unbekannter Säure bzw. Base entspricht, wird als Äquivalenzpunkt (ÄP) bezeichnet.
Somit steigt zu Beginn einer Titration der pH-Wert zunächst nur langsam an. In der Nähe des Äquivalenzpunktes jedoch ändert er sich bei nur sehr geringer Volumenzugabe an Maßlösung (z. B. NaOH) sehr stark und geht in den basischen Bereich über. Die weitere Zugabe führt nun wiederum zu immer geringeren Änderungen des pH-Werts, weil der zunehmende Überschuß an Natronlauge wegen des ebenfalls logarithmischen Zusammenhanges zwischen und pH-Wert zu immer geringeren relativen Änderungen führt.
-

-
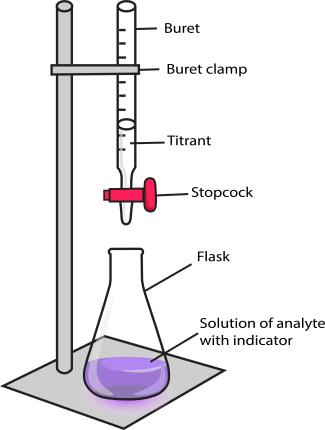
Kallayanee Naloka - shutterstock
Aus dieser pH-Änderung bei der Titration einer starken Säure mit einer starken Base ergibt sich die in Bild 3 dargestellt Titrationskurve. Der Äquivalenzpunkt entspricht dem Wendepunkt der Kurve und fällt mit dem Neutralpunkt (pH = 7) zusammen. Folglich ist
Der Äquivalenzpunkt dieser Titration ist durch einen großen pH-Sprung um mehr als fünf Einheiten gekennzeichnet. Die Bestimmung des Äquivalenzpunktes kann auf unterschiedliche Weise erfolgen. Mit dem pH-Meter kann die Änderung des pH-Wertes mithilfe von Elektroden gemessen werden. Das Potenzial solcher Elektroden wie der Glaselektrode hängt dabei nur von der in der Lösung ab, da das Standardelektrodenpotenzial bei konstanter Temperatur ebenfalls konstant ist.
Am häufigsten werden zur Erkennung des Äquivalenzpunktes jedoch Säure-Base-Indikatoren eingesetzt. Ein Säure-Base-Indikator ist eine schwache organische Säure, bei der das deprotonierte Säurerest-Anion eine andere Farbe aufweist als das neutrale Säuremolekül.
Das Protolysegleichgewicht des Indikators ergibt sich aus der Gleichung:
Saure Lösungen erscheinen in der Farbe der Säure HInd, basische Lösungen in der Farbe des Anions Ind-. Liegt der pH-Wert im Bereich des des Indikators, ergibt sich eine Mischfarbe von beiden. Die Zugabe der Maßlösung verschiebt das Protolysegleichgewicht des Indikators entsprechend dem Massenwirkungsgesetz.
Im pH-Bereich in der Nähe des -Werts wirkt sich diese Konzentrationsänderung besonders stark auf die Farbe der Lösung aus. Diesen pH-Bereich bezeichnet man als Umschlagsbereich des Indikators. In Abhängigkeit von ihren -Werten haben Indikatoren unterschiedliche Umschlagsbereiche. Mehrwertige Indikatoren haben mehrere Umschlagsbereiche.
Die meisten Säure-Base-Indikatoren sind Farbstoffmoleküle mit einem delokalisierten
Titration einer schwachen Säure mit einer starken Base
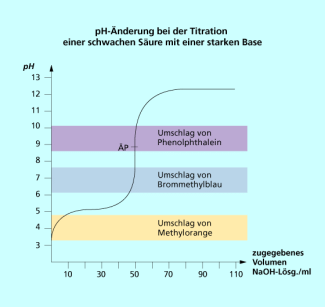
Titriert man eine schwache Säure mit einer starken Base oder eine schwache Base mit einer starken Säure, sind Neutralpunkt und Äquivalenzpunkt nicht identisch. Betrachten wir als Beispiel die Titration von Essigsäure mit Natriumhydroxid als starker Base (Bild 4):
Am Äquivalenzpunkt, dem Wendepunkt der Titrationskurve, sind die Konzentration von gleich. Während keine Rückreaktion mit Wasser eingehen, reagiert das Acetat-Ion als korrespondierende Base der schwachen Essigsäure merklich mit Wasser:
In der Lösung überwiegen somit die die Lösung ist am Äquivalenzpunkt basisch, pH > 7. Das lässt sich auch quantitativ bestimmen. Geht man von dem in der entsprechenden Titrationskurve gezeigten Beispiel aus, in dem 50 ml Essigsäure mit einer Natronlauge gleicher Konzentration titriert wird, so liegt am Äquivalenzpunkt eine Acetatkonzentration von vor. Unter Verwendung der Gleichung ergibt sich durch Einsetzen der Werte für und
Folglich wird der Äquivalenzpunkt bei pH = 8,72 erreicht. Deshalb muss für die Titration ein Indikator wie Phenolphthalein gewählt werden, der in diesem pH-Bereich einen Farbumschlag zeigt.
Bei der Titration einer schwachen Säure mit einer starken Base ist auch die Änderung des pH-Wertes deutlich kleiner als bei einer starken Säure. Das liegt daran, dass Lösungen schwacher Säuren schon zu Beginn höhere pH-Werte aufweisen und außerdem Pufferlösungen mit ihren korrespondierenden Basen bilden.
Natürlich kann man auch umgekehrt die Konzentration einer Base durch Titration mit einer Säure bestimmen. Für die Berechnung des Ergebnisses spielt es keine Rolle, ob in der Testlösung eine starke oder eine schwache Säure bzw. Base vorliegt. Bis zum Äquivalenzpunkt erfolgt in jedem Fall ein vollständiger Stoffumsatz. Folglich kann aus dem Volumen und der Konzentration der Maßlösung die Konzentration oder der Gehalt der Testlösung stöchiometrisch sehr einfach berechnet werden (Rechenbeispiel).