Aminosäuren
Als Aminosäuren bezeichnet man organische Verbindungen die über mindesten je ein Amino-Gruppe und mindestens eine Carboxy-Gruppe verfügen. Die in der Natur am häufigsten vorkommenden Aminosäuren sind die -Aminosäuren, sie werden auch als Bausteine des Lebens bezeichnet. 22 dieser Aminosäuren werden als biogene Aminosäuren bezeichnet. Aus diesen werden Proteine aufgebaut und sie werden in der DNA codiert.
Die 22 biogenen Aminosäuren enthalten zum Teil weitere funktionelle Gruppen. Aminosäuren liegen in einer zwitterionischen Struktur vor, es sind Ampholyte.
Aminosäuren sind organische Verbindungen, die über mindestens eine Amino-Gruppe und mindestens eine Carboxy-Gruppe verfügen. In Abhängigkeit der Stellung der Amino-Gruppe zum Kohlenstoffatom der Carboxy-Gruppe unterscheidet man -, -, - und -Aminosäuren. Viele der in der Natur vorkommenden Aminosäuren verfügen über weitere funktionelle Gruppen. Man kennt heute ca. 500 natürliche Aminosäuren. Dabei sind die am Aufbau der Proteine beteiligten -Aminosäuren besonders wichtig und insgesamt sind auch die -Aminosäuren die häufigsten in der Natur vorkommenden Aminosäuren.
Als erste frei in der Natur vorkommende Aminosäuren wurde 1806 das Asparagin von VAUQUELIN und ROBIQUET aus dem Saft von Spargelpflanzen (Asparargus) entdeckt und isoliert.
-
Bei Aminosäuren kann die Stellung der Aminogruppe unterschiedlich sein. Danach werden sie zunächst eingeteilt.

Nomenklatur
Die in der Natur vorkommenden -Aminosäuren werden mit Trivialnamen bezeichnet. Die Bezeichnung richtet sich dabei im Wesentlichen nach dem ursprünglichen Protein, aus dem die Aminosäure zum ersten Mal isoliert wurde z. B. Asparagin aus Spargelsaft (lat: asparagus = Spargel), Serin aus Seide (griech: seros = Seidenraupe), Cystein aus Blasensteinen (griech: cystis = die Blase), Tyrosin aus Käse (griech. tyros: Käse). Einige Namen von Aminosäuren beruhen auch auf strukturellen Ähnlichkeiten der Aminosäure zu anderen Naturprodukten z. B. Threonin zum Monosaccharid Threose, Valin zur iso-Valeriansäure (3-Methylbutansäure).
Die -Aminosäuren unterscheiden sich untereinander nur im Rest R am -Kohlenstoffatom dieser Rest wird als Seitenkette bezeichnet
Allgemeine Reaktivität von Aminosäuren
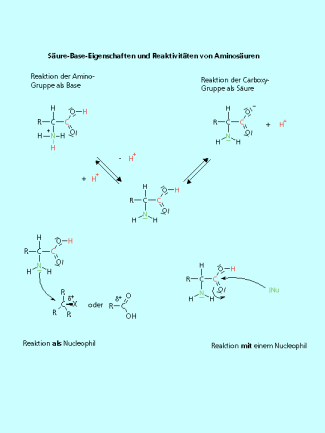
Das Stickstoffatom der Amino-Gruppe ist ein basisches Zentrum, denn es hat ein freies Elektronenpaar, die Carboxy-Gruppe besitzt saure Eigenschaften. Folglich enthält das Molekül funktionelle Gruppen in einem Molekül, die eine entgegensetzte Reaktivität haben.
-
Die Aminogruppe ist basich, die Carboxylgruppe sauer. Aminosäuren sind also Ampholyte und reagieren mit Säuren und mit Basen.
Die α-Aminosäuren
- Biogene Aminosäuren
Die -Aminosäuren nehmen eine Sonderstellung ein. Sie werden häufig als die Bausteine des Lebens bezeichnet. Die -Aminosäuren sind die Bausteine der Proteine und Polypeptide. Bei allen Lebewesen werden 22 dieser -Aminosäuren in der DNA/RNA codiert. Das heißt, zum allergrößten Anteil enthält unsere DNA den Bauplan für die Primärstruktur von Polypeptiden und Proteinen. Diese Aminosäuren werden als proteinogene oder biogene Aminosäuren bezeichnet.
-
Die 22 biogenen Aminosäuren. Aus ihnen werden die Proteine gebildet.
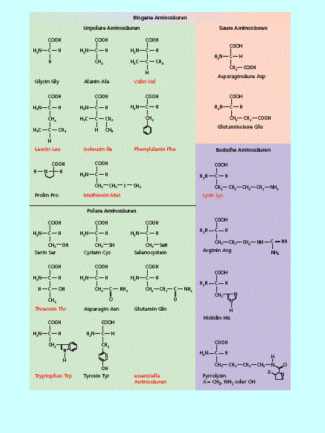
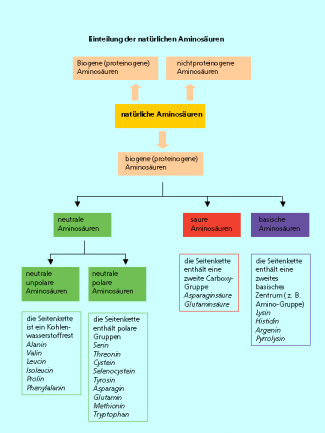
Sie werden unterteilt in neutrale, saure und basische Aminosäuren. Saure Aminosäuren haben eine zweite Carboxy-Gruppe, basische Aminosäuren haben außer der Amino-Gruppe am -Kohlenstoffatom mindestens ein weiteres Stickstoffatom. Mit Ausnahme der kleinsten biogenen Aminosäure, dem Glycin, haben alle -Aminosäuren am -Kohlenstoffatom ein Chiralitätszentrum. In die natürlichen Proteine werden nur die L--Aminosäuren eingebaut.
-
Die Unterteilung der natürlichen Amisnosäuren.
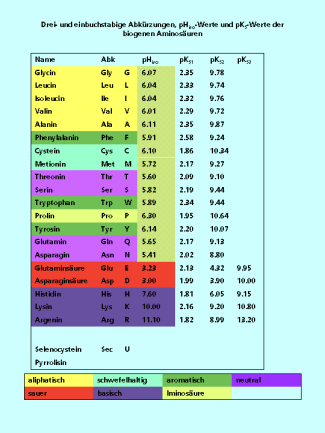
Drei- und einbuchstabige Abkürzungen der Aminosäuren
Für die biogenen Aminosäuren gibt es eine dreibuchstabige Abkürzung. Dabei werden häufig die ersten drei Buchstaben des Namens benutzt z. B. Alanin = Ala, Cystein = Cys, Phenylalanin = Phe. Ausnahmen bilden Aspargin = Asn und Glutamin = Gln, um sie von der Asparaginsäure = Asp und der Glutaminsäure = Glu zu unterscheiden. Auch beim Tryptophan = Trp wird von dieser Regel abgewichen um Verwechslungen mit dem Tyrosin = Tyr zu vermeiden. Biochemiker nutzen häufig eine einbuchstabige Abkürzung.
Veränderte Aminosäuren
In einigen Fällen findet man in bestimmten Proteinen auch andere Aminosäuren. Es sind ursprünglich proteinogene Aminosäuren, die nach dem Einbau in Proteine an der Seitenkette verändert worden sind (posttranslationelle Modifikation). Sie haben wichtige Funktionen in Enzymen und Hormonen.
-
Als Abkürzungen für die Aminosäuren wird Code verwendet. Entweder aus 3 Buchstaben oder aus nur einem.
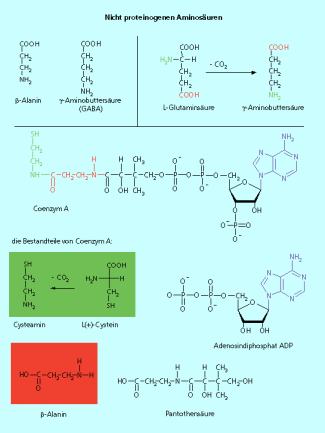
Nichtproteinogene Aminosäuren
Dazu gehören z. B. das -Alanin und die -Aminobuttersäure. Das -Alanin ist Bestandteil des Coenzyms A , die -Aminobuttersäure (engl.: -Amino-butyric acid GABA) ist ein wichtiger Neurotransmitter. Das für das Coenzym A notwendige-Alanin wird vom Menschen aus dem Vitamin B-Komplex aufgenommen.
Säure-Base-Reaktion
Aminosäuren sind Ampholyte. Das heißt, sie können sowohl als BRÖNSTED-Base (Aufnahme eines Protons) als auch als BRÖNSTED-Säure (Abgabe eines Protons) reagieren. Anders als bei dem Ampholyten Wasser sind das saure und das basische Zentrum durch Kohlenstoffatome getrennt. Deshalb liegen auch die Aminosäuren als Zwitterionen vor. Durch die Aufnahme eines Protons wird die Aminosäure in ein Kation überführt, durch die Abgabe eines Protons wird die Aminosäure zum Anion. Je nach pH-Wert der Umgebung liegt die Aminosäure demnach als Anion, Kation, oder als Zwitterion vor.
-
Die Nichtproteinogenen Aminosäuren beta-alanin und GABA und die Zusammensetzung von Coenzym A, das unter anderem beta-Alanin enthält.
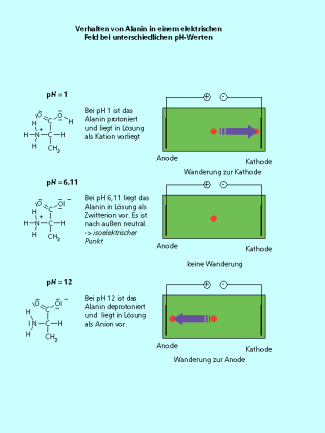
Der isoelektrische Punkt
Bringt man die Aminosäure (z. B. in einer Lösung oder einem Gel) in ein elektrisches Feld, dann bewegt sie sich, je nach ihrer Ladung, auf die Anode oder die Katode zu. Liegt die Aminosäure als Zwitterion vor, heben sich die Ladungen auf und das Molekül ist ungeladen. Im elektrischen Feld bewegt sich eine so geladene Aminosäure nicht. Dies wird als isoelektrischer Punkt bezeichnet. Der pH-Wert der Lösung an diesem Punkt heißt . Bei jeder Aminosäure liegt der isoelektrische Punkt bei einem anderen , abhängig von der Lage ihrer Protonierungs-Deprotonierungs-Gleichgewichte.
-
Die Ladung der Ainosäuren bestimmt ihre "Wanderung" im elektrischen Feld. Am Isoelektrischen Punkt ist die Aminosäure insgesamt neutral und wandert nicht. Die Ladung der Aminosäure ist vom pH-Wert abhängig.
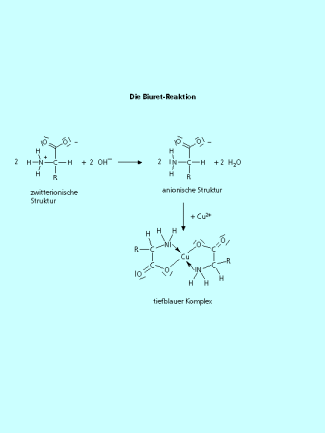
Nachweisreaktionen der Aminosäuren (Farbreaktionen)
Bei der BIURET-REAKTION wird die Ausbildung von Komplexen der Aminosäuren mit Kupfer(II)-Ionen in alkalischer Lösung ausgenutzt. Es entstehen tiefblau gefärbte Lösungen. Auch Eiweiße geben die gleiche Reaktion. Nach einer entsprechenden Kalibration kann die Reaktion sogar zur quantitaven Eiweißbestimmung benutzt werden.
-
In der Biuret-Reaktion bilden Aminosäuren nach der Deprotonierunhg mit einer Base mit Cu(II)-Kationen einen tiefblau gefärbten Komplex.
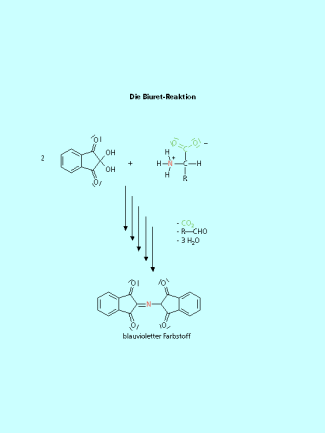
Aminosäuren reagieren mit Ninhydrin unter Ausbildung eines blauvioletten Farbstoffes. Bei dieser Reaktion wird das Stickstoffatom der Aminosäuren übertragen. Der gebildete Farbstoff besteht aus zwei Ninhydrin-Einheiten, die über ein Stickstoffatom verbunden sind. Die Reaktion verläuft über mehrere Stufen. Sie beginnt mit der Decarboxylierung der Aminosäure. Es folgt ein Angriff des Stickstoffatoms auf das Kohlenstoffatom des Ninhydrins.
-
Mit Ninhydrin bilden Aminosäuren einen blauviolett gefärbten Komplex. Zur Bildung diese Komolexes wird in komplizierter Reaktionsabfolge das Stickstoffatom der Aminosäure verwendet.
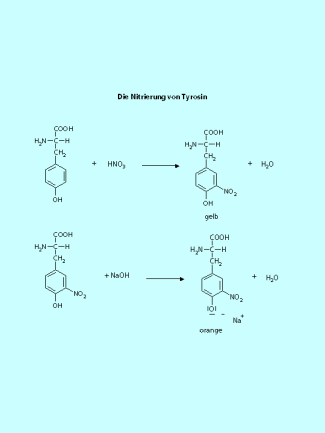
Die Aminosäure Tyrosin regiert mit konzentrierter Salpetersäure. Es entsteht eine gelbe Lösung. Wird das Reaktionsprodukt mit Ammoniak-Lösung alkalisch gemacht, beobachtet man eine Farbvertiefung nach dunkelorange. Der Phenolring wird durch die Salpetersäure nitriert, die Farbvertiefung resultiert aus der Deprotonierung der sauren phenolischen Hydroxy-Gruppe. Diese Reaktion ist auch die Grundlage der XANTHOPROTEIN-REAKTION als Nachweis-Reaktion für Eiweiße.
Aminosäuren im Alltag
Glutamat als Gewürz
Entgegen den einer langen Hypothese, dass die menschliche Zunge nur vier unterschiedliche Geschmacksrichtungen wahrnehmen kann, stellten japanische Wissenschaftler fest, dass wir mindestens über einen fünften Geschmackssinn verfügen. Dieser Geschmackssinn heißt Umami - eine Übersetzung ist schwierig, wir müssten dazu "fleischig" oder "aminosäurig" sagen. Die japanische Gruppe konnte nachweisen, dass unsere Geschmackzellen Rezeptoren haben, die bestimmte Aminosäuren wie die Glutaminsäure (der Geschmacksverstärker Glutamat ist das Natriumsalz der Glutaminsäure) erkennen. Bei dieser Erkennung wird ein Botenstoff ausgesandt, der eine Signalübermittlung an das Gehirn erzeugt.
-
Auf dem gleichen Reaktionsprinzip wie die Nitrierung von Tyrosin beruht die Xanthoprotein-Reaktion, die als Nachweis für Eiweiße dient.
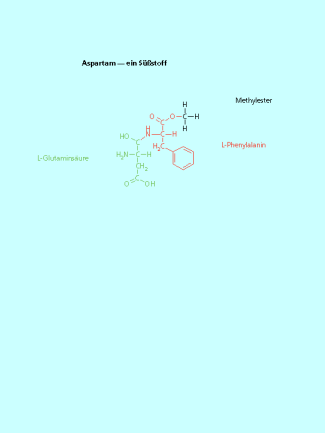
Aminosäure-Derivate als Süßstoffe
Diabetiker müssen den Konsum von Kohlenhydraten stark einschränken. Deshalb wurden Süßstoffe entwickelt, die nicht auf der Basis von -Glucose-Einheiten einen süßen Geschmack erzeugen. Ein Beispiel ist das Aspartam, dass eine 200fache Süßkraft gegenüber von Rohrzucker besitzt. Aspartam ist ein Dipetid aus L-Asparaginsäure und L-Phenylalanin. Die Peptidbindung wird gebildet aus der Amino-Gruppe des Phenylalanins und der Carboxy-Gruppe der Asparginsäure am -Kohlenstoffatom. Die Carboxy-Gruppe des Phenylalanins wurde verestert, die zweite Carboxy-Gruppe der Asparaginsäure bleibt unverändert.
-
Der Süßstoff Aspartam besitzt die 200-fache Süßkraft von gewöhnlichem Haushaltszucker (Rohrzucker ).
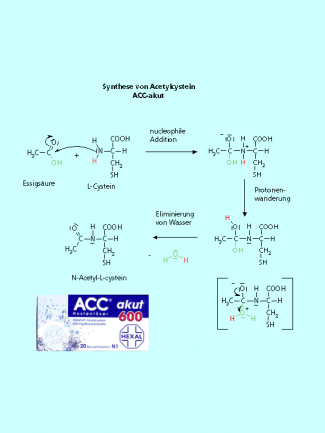
ACC-akut bei Husten
Im ACC-akut befindet sich eine veränderte Aminosäure, das Acetylcystein. Das Acetylcystein ist ein starkes Reduktionsmittel. Es ist in der Lage, Disulfidbrücken zu spalten. Der menschliche Schleim enthält sehr viele Disulfidbrücken. Durch die Spaltung dieser Disulfidbrücken, sinkt die Viskosität des Schleimes. Er wird dadurch "dünnflüssiger". Das erleichtert ein Abhusten der schleimigen Sekrete. Deshalb empfiehlt der Arzt bei Erkältungskrankheiten mit starker Schleimbildung die Einnahme von ACC-akut. Das Acetylcystein entsteht bei der Umsetzung von Cystein mit einem Essigsäurederivat wird ein Carbonsäureamid gebildet. Das Schema zeigt die formale Umsetzung mit Essigsäure, in der Technik muss aber Essigsäurechlorid oder Essigsäureanhydrid benutzt werden, da mit der freien Essigsäure nur eine Säure-Base-Reaktion statt findet
-
ACC - Acetylcystein macht den Schleim dünnflüssiger und unterstützt so das "Abhusten".
Suche nach passenden Schlagwörtern
- Threonin
- Eiweisse
- GABA
- Coenzym A
- Peptide
- Tryptophan
- Asparagin
- ACC
- Valin
- Leucin
- Biruet-Reaktion
- Hormone
- Serin
- biogen
- C-Teiminuns
- ACC-akut
- proteinogene
- Amisosäuren
- Asparaginsäure
- Proteine
- Glutamat
- Enzyme
- Zwitterion
- Süßstoff
- Aspartam
- Alanin
- Cystein
- Phenylalanin
- N-Terminus
- Xanthoprotein-Reaktion
- Glutamin
- Ninhydrin
- isoelektrischer Punkt
- pH-Wert
- Seitenkette
- Glycin
- Glutaminsäure
- Acetylcystein

