anorganische Reaktionen
Chemische Reaktionen sind Vorgänge, bei denen aus den Ausgangsstoffen neue Stoffe (Reaktionsprodukte) mit neuen Eigenschaften entstehen. Es erfolgt eine Stoffumwandlung, die immer mit einer Energieumwandlungen verbunden ist.
Chemische Reaktionen können mit Wortgleichungen oder Formelgleichungen wiedergegeben werden.
Chemische Reaktionen können nach verschiedenen Gesichtspunkten unterteilt werden.
Physikalische Vorgänge
Führt man dem Wasser Wärme zu, so siedet es bei einer Temperatur von 100 °C. Es entsteht Wasserdampf.
Kühlt man den Wasserdampf unter die Siedetemperatur ab, so entsteht wieder flüssiges Wasser mit denselben Eigenschaften wie vorher.
Durch das Sieden und Kondensieren hat sich nur der Aggregatzustand des Stoffes Wasser geändert. Es entstand aber kein neuer Stoff. Ähnliches beobachtet man beim Gefrieren und Schmelzen von Stoffen.
Auch bei einfachen Mischungsvorgängen, wie dem Auflösen von Zucker in Kaffee oder dem Mischen von Sand mit Wasser, ändern die Stoffe nur ihre physikalischen Eigenschaften.
Solche Gemische können durch physikalische Prozesse wieder getrennt werden, z. B. kann man Sand und Wasser unverändert durch Filtration von einander getrennt werden.
Bei all diesen physikalische Vorgängen findet keine Stoffumwandlung statt, d. h. die Stoffe werden chemisch nicht verändert.
Chemische Reaktionen als Stoffumwandlung
Im Gegensatz zu einer Mischung von Sand (Siliciumdioxid) mit Wasser, erfolgt bei der Mischung von verdünnter Schwefelsäure mit verdünntem Kalkwasser (Calciumhydroxid) eine Stoffumwandlung.
Bei der Wechselwirkung der Lösungen von Schwefelsäure mit Calciumhydroxid ist weißes, in Wasser schwer lösliches Calciumsulfat entstanden.
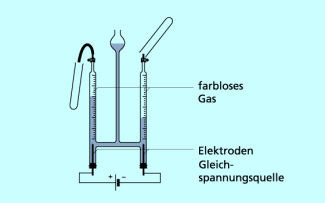
Auch bei der Zersetzung von Wasser im hofmannschen Wasserzersetzungsapparat (siehe Bild 2) entstehen neue Stoffe mit neuen Eigenschaften. Aus flüssigem Wasser werden zwei unterschiedliche Gase gebildet.
Das eine Gas ist farblos, geruchlos, brennbar und beeinflusst einen glimmenden Holzspan nicht. Dieses Gas ist Wasserstoff. Das andere ist auch farblos und geruchlos, aber nicht brennbar und lässt einen glimmenden Holzspan hell aufflammen. Dieses Gas ist Sauerstoff.
Chemische Reaktionen sind Vorgänge, bei denen durch Spaltung, Umordnung und Neuknüpfung chemischer Bindungen eine Stoffumwandlung stattfindet.
Zur Beschreibung der Stoffumwandlung formuliert der Chemiker Reaktionsgleichungen. Die einfachste Variante ist die Wortgleichung. Die Wortgleichung für die elektrolytische Zersetzung von Wasser lautet:
Die Stoffe, die vor einer chemischen Reaktion existieren, heißen Ausgangsstoffe (Edukte). Sie stehen in jeder Reaktionsgleichung vor dem Pfeil. Der Pfeil gibt die Richtung der chemischen Reaktion an. Stoffe, die nach einer chemischen Reaktion vorliegen, bezeichnet man als Reaktionsprodukte. Sie stehen hinter dem Pfeil bzw. auf der rechten Seite der Gleichung.
Wesentlich mehr Informationen kann den ausführlichen Reaktionsgleichungen unter Nutzung von Symbolen und Formeln (Formelgleichung) entnommen werden. Diese Gleichungen treffen quantitative Aussagen, denn die Art und die Zahl der Teilchen (Atome, Ionen) ist auf der Seite der Ausgangsstoffe und der Endprodukte gleich. Beim Aufstellen der Formelgleichungen müssen die Gesetze der Erhaltung der Masse sowie der multiplen und konstanten Proportionen berücksichtigt werden.
Die Formelgleichung für die elektrolytische Zersetzung von Wasser lautet:
Ein Doppelpfeil als Reaktionspfeil zeigt an, dass die Reaktion umkehrbar ist und dass Ausgangsstoffe und Reaktionsprodukte in einem chemischen Gleichgewicht vorliegen. Die Mehrzahl chemischer Reaktionen sind Gleichgewichtsreaktionen.
-
Wasser wird im hofmannschen Apparat elektrolytisch zersetzt.
Chemische Reaktion als Energieumwandlung
Die Spaltung, Umordnung und Neuknüpfung chemischer Bindungen ist auch mit energetischen Erscheinungen verbunden. So wird bei der Reaktion zwischen Schwefelsäure und Calciumhydroxid Energie in Form von Wärme frei. Dagegen muss zur Wasserzersetzung Energie in Form von elektrischer Energie zugeführt werden.
Chemische Reaktionen sind immer mit Energieumwandlungen verbunden.
Je nachdem, ob insgesamt bei einer Reaktion thermische Energie als Wärme zugeführt werden muss oder abgegeben wird, unterscheidet man exotherme und endotherme Reaktionen.
Wird bei einer chemischen Reaktion Wärmeenergie abgegeben, so spricht man von einer exothermen chemischen Reaktion (ex = nach außen, therm = Wärme).
Wenn bei einer chemischen Reaktion ständig Wärmeenergie zugeführt werden muss, so liegt eine endotherme chemische Reaktion (endo = nach innen) vor.
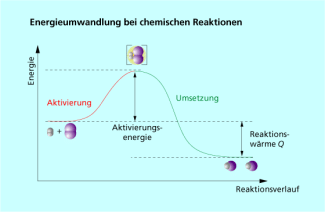
Dazu kommt, dass selbst bei einer exothermen Reaktion, wie der Bildung von Wasser durch die Knallgasreaktion, dem Gemisch der Ausgangsstoffe erst eine Energie zur Aktivierung zugeführt werden muss (siehe Bild 3). Diese Energie bezeichnete der schwedische Chemiker SVANTE ARRHENIUS als Aktivierungsenergie.
-
Die Energieumwandlung bei chemischen Reaktionen kann durch Energiediagramme veranschaulicht werden.
Arten chemischer Reaktionen
Chemische Reaktionen lassen sich nicht nur nach energetischen Gesichtspunkten klassifizieren. Nach dem Aggregatzustand der Reaktanten unterteilt man in Gasreaktionen, Reaktionen in Lösungen und Festkörperreaktionen.
Stellt man dagegen die Art der reagierenden Teilchen in den Vordergrund, dann unterscheidet man zwischen Molekül-, Ionen- oder Radikalreaktionen.
In der organischen Chemie betrachtet man dagegen primär die Änderung des Bindungszustands der Kohlenstoffatome und unterscheidet zwischen Substitution, Addition und Eliminierung. Eine Übersicht über die organischen Reaktionstypen ist in einem anderen Beitrag auf dieser CD gegeben.
Als sehr sinnvoll hat sich die nachfolgende Klassifizierung nach der Art der bei der Reaktion ausgetauschten Teilchen erwiesen. Dabei unterscheidet man zwischen:
- Redoxreaktionen
- Säure-Base-Reaktionen
- Fällungsreaktionen
- Komplexreaktionen
Diese Einteilung wird vor allem in der anorganischen und allgemeinen Chemie bevorzugt.
Redoxreaktionen
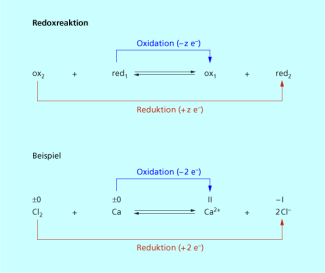
Redoxreaktionen sind Reaktionen mit Elektronenübergang. Dabei sind die Teilreaktionen Oxidation und Reduktion miteinander gekoppelt, d. h. sie laufen gleichzeitig ab.
Bei der Teilreaktion Oxidation erfolgt eine Elektronenabgabe. Bei der Teilreaktion Reduktion erfolgt eine Elektronenaufnahme.
Das Oxidationsmittel ist der Reaktionspartner, der Elektronen aufnimmt und das Reduktionsmittel der Reaktionspartner, der Elektronen abgibt. Die Vorgänge der Oxidation und der Reduktion sind über korrespondierende Redoxpaare miteinander verknüpft.
Beispiele für Redoxreaktionen sind der Prozess der Wasserbildung aus den Elementen. Aber auch bei dem seit über 500 000 Jahren vom Menschen genutzten Feuer handelt es sich wie bei allen Verbrennungsprozessen um eine bedeutende Redoxreaktion.
Alle elektrochemischen Prozesse sind Redoxreaktionen. Weitere Beispiele für Redoxreaktionen sind:
-
Redoxreaktionen sind immer gekoppelte Reduktions-Oxidations-Prozesse.
Säure-Base-Reaktionen
Säure-Base-Reaktionen sind nach JOHANNES NICOLAUS BRÖNSTED (1879-1947) Reaktionen, die unter Protonenübergang verlaufen. Dabei geben die Säuren Protonen an die als Reaktionspartner zur Verfügung stehenden Basen ab.
Ähnlich wie bei den Redoxreaktionen bilden sich Säure-Base-Gleichgewichte mit korrespondierenden Säure-Base-Paaren aus:
![]()
Im Beispiel sind die korrespondierenden Säure-Base-Paare und miteinander verknüpft. Diese Reaktion von Ammoniak mit Wasser nennt man Protolyse.
Zu den Säure-Base-Reaktionen zählen u. a. die o. g. Umsetzung von Schwefelsäure mit Calciumhydroxid sowie die Protolysen aller Säuren und Basen mit Wasser.
Auch im Alltag begegnen uns Säure Base-Reaktionen auf Schritt und Tritt:
Fällungsreaktionen
Bei einer Fällungsreaktion bildet sich bei der Umsetzung zweier Reaktionspartner in einer homogenen Lösung ein Niederschlag eines schwer löslichen Reaktionsproduktes. Dabei werden Ionen übertragen.
Da zwei Phasen, eine homogene flüssige (Lösung) und eine feste (Niederschlag) vorliegen, spricht man auch von einer heterogenen Reaktion. Fällungsreaktionen haben große Bedeutung in der qualitativen chemischen Analyse (Nachweisreaktionen), bei der quantitativen Bestimmung der Ionen (Gravimetrie) und bei der Frisch- und Abwasserbehandlung. Auch die Rauchgasentschwefelung in Kraftwerken ist eine Fällungsreaktion.
Komplexreaktionen
Komplexreaktionen sind Reaktionen, an denen sogenannte Verbindungen höherer Ordnung beteiligt sind. Bei der Bildung solcher Komplexe reagieren Elektronenpaarakzeptoren (z. B. Metall-Kationen) mit Elektronenpaardonatoren (Anionen oder Molekülen). Durch Ausbildung sogenannter Donor-Akzeptor-Bindungen entstehen Komplexverbindungen.
Komplexreaktionen spielen eine wichtige Rolle in der Biochemie, z. B. bei der Sauerstoffübertragung im Blut, aber auch in der chemischen Analytik, z. B. beim Eiweiß-Nachweis durch die BIURET-Reaktion (Bild 7).
Der Ablauf von Komplexreaktionen ist ebenso wie die anderen Reaktionsarten in anderen Beiträgen auf dieser DVD ausführlicher beschrieben.
-
Die violette Färbung der Eiweißlösung bei der BIURET-Reaktion beruht auf der Bildung komplexer Verbindungen.

Heinz Mahler-H.Mahler
Suche nach passenden Schlagwörtern
- Reaktion
- Hydroxid-Ionen
- Hydronium-Ionen
- Säure-Base-Reaktionen
- SVANTE ARRHENIUS
- Elektronendonator
- Säuren
- Reaktionsprodukte
- Basen
- Redoxreaktion
- Protonenakzeptoren
- Wasser
- Protonendonatoren
- hofmannschen Apparat
- Fälllungsreaktionen
- chemisch
- Ausgangsstoffe
- JOHANNES NICOLAUS BRÖNSTED
- chemische Reaktion
- Oxonium-Ionen
- Elektronenakzeptor
- Reduktionsmittel
- Energieumwandlungen
- Protonenübertragung
- Oxidation
- Reduktion
- Oxidationszahl

