Kohäsion und Adhäsion
Zwischen den Teilchen von Stoffen wirken zwischenmolekulare Kräfte, auch Molekularkräfte genannt. Die Erscheinung, dass zwischen den Teilchen eines Körpers anziehende Kräfte wirken, wird als Kohäsion bezeichnet. Die zwischen den Teilchen wirkenden Kräfte heißen Kohäsionskräfte.
Die Erscheinung, dass zwischen den Teilchen verschiedener Körper anziehende Kräfte wirken, wird als Adhäsion bezeichnet. Die zwischen den Teilchen wirkenden Kräfte heißen Adhäsionskräfte.
Eine Folge der Molekularkräfte ist die Oberflächenspannung, die unter anderem dazu führt, dass Regentropfen die Form einer Kugel einnehmen.
Einen dicken Nagel kann man verbiegen. Ein Kugelschreiber behält eine bestimmte Form. Kreide haftet an der Tafel, Farbe an der Wand. Das alles zeigt, dass sowohl zwischen den Teilchen eines Körpers (z. B. Nagel) als auch zwischen den Teilchen verschiedener Stoffe (z. B. Farbe und Wand) anziehende Kräfte wirken.
Kohäsion und Kohäsionskräfte
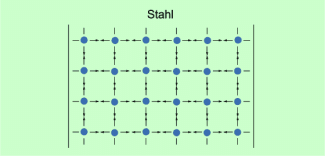
Die Erscheinung, dass zwischen den Teilchen eines Körpers anziehende Kräfte wirken, wird als Kohäsion bezeichnet. Die entsprechenden Kräfte nennt man Kohäsionskräfte (Bild 1). Kohäsionskräfte bewirken die Festigkeit und Elastizität von Körpern. Sie sind bei festen Körpern groß, bei Flüssigkeiten geringer und bei Gasen sehr klein. Die Kohäsionskräfte sind elektrischen Ursprungs und werden auch nach ihrem Entdecker, dem niederländischen Physiker JOHANNES DIDERIK VAN DER WAALS (1837-1923), van der waalssche Kräfte genannt.
Fallen die Schwerpunkte der positiven und negativen Ladung eines Moleküls oder Atoms nicht zusammen, so entsteht ein elektrischer Dipol.
Der ruft im benachbarten Molekül oder Atom eine entgegengerichtete Polarisation hervor, was eine schwache Anziehung zur Folge hat, die Kohäsionskraft.
-
Zwischen den Teilchen eines Körpers wirken anziehende Kräfte, die Kohäsionskräfte.
Adhäsion und Adhäsionskräfte
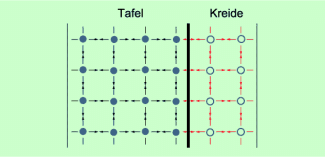
Die Erscheinung, dass zwischen den Teilchen verschiedener Körper anziehende Kräfte wirken, wird als Adhäsion bezeichnet. Die entsprechenden Kräfte nennt man Adhäsionskräfte (Bild 2).
Adhäsionskräfte bewirken das Haften verschiedener Körper aneinander (Kreide an der Tafel, Farbe an der Wand, Leim an Holz). Auch die Wirkungsweise von Klebstoffen beruht auf der Adhäsion. Der Betrag von Adhäsionskräften hängt von den jeweiligen Stoffen ab und kann sehr unterschiedlich sein. Bei Klebstoffen, Farben und Lacken ist er besonders groß, bei den meisten anderen Stoffen relativ klein.
-
Zwischen den Teilchen verschiedener Körpers wirken ebenfalls anziehende Kräfte, die Adhäsionskräfte.
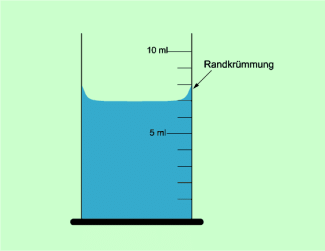
Adhäsion tritt z. B. auch zwischen Wasser und den Gefäßwänden auf, etwa bei Messzylindern. Aufgrund der Adhäsionskräfte kommt es zu einer Randkrümmung (Bild 3). Beim Ablesen an Messzylindern muss man diese Randkrümmung beachten. So beträgt das Volumen in Bild 3 nicht 8 ml, sondern 7 ml.
-
Die Randkrümmung, wie sie bei Messzylindern zu beobachten ist, kommt durch Molekularkräfte zustande.
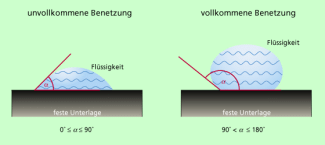
Vollkommene und unvollkommene Benetzung
Berührt eine Flüssigkeit eine feste Unterlage, so können zwei unterschiedliche Situationen auftreten.
- Sind die wirkenden Adhäsionskräfte zwischen der Flüssigkeit und der Unterlage größer als die Kohäsionskräfte im Innern der Flüssigkeit, so läuft sie auseinander (Bild 4). Man nennt das eine vollkommene Benetzung. Für den Winkel (Bild 4 links) gilt:
- Sind die wirkenden Adhäsionskräfte kleiner als die Kohäsionskräfte der Flüssigkeit, so zieht sie sich tropfenförmig zusammen (Bild 4 rechts). Es liegt dann eine unvollkommene Benetzung vor. Für den Winkel gilt nun:
Die Oberflächenspannung - eine Folge der Kohäsion
Im Innern einer Flüssigkeit heben sich die Kohäsionskräfte auf, da jedes Molekül von gleichartigen Molekülen umgeben ist. Anders dagegen ist die Situation an der Oberfläche. Dort fehlen die nach außen gerichteten Kräfte, was eine resultierende Kraft in Richtung Inneres der Flüssigkeit zur Folge hat. Um ein Molekül an die Wasseroberfläche zu bringen, muss daher Arbeit gegen diese resultierende Kraft geleistet werden. Die Teilchen der oberen Flüssigkeitsschicht besitzen demzufolge auch eine größere potenzielle Energie, die man Oberflächenenergie nennt.
Da ein System stets in den Zustand kleinster Energie anstrebt, sind Flüssigkeitsoberflächen immer Minimalflächen. Dies erklärt, warum ein Tropfen eine Kugelform besitzt. Unter den Körpern gleichen Volumens ist die Kugel der mit der kleinsten Oberfläche.
Will man eine Flüssigkeitsoberfläche vergrößern, so muss eine bestimmte Arbeit aufgebracht werden. Der Quotient ist eine für die Flüssigkeit charakteristische Größe und wird Oberflächenspannung genannt. Es gilt also:
-
Vollkommene und unvollkommene Benetzung: Der markierte Winkel hat unterschiedliche Werte.