Leitung in Flüssigkeiten
In Flüssigkeiten erfolgt nur dann ein Leitungsvorgang, wenn durch Dissoziation frei bewegliche (wanderungsfähige) Ionen vorhanden. Beim Anlegen einer Spannung und damit beim Vorhandensein eines elektrischen Feldes bewegen sich die Ionen gerichtet. Es wird elektrische Energie in thermische Energie umgewandelt. Eine für Anwendungen wichtige Besonderheit bei Leitungsvorgängen in Flüssigkeiten besteht darin, dass mit den Ionen nicht nur ein Transport von Ladungen, sondern auch ein Stofftransport erfolgt. Das wird z.B. beim Galvanisieren oder beim Lackieren von Autoteilen genutzt.
Leitungsvorgänge in Flüssigkeiten
Leitungsvorgänge in Flüssigkeiten spielen für die Technik eine wichtige Rolle. Als Stichwörter seien hier nur Akkumulatoren, die verschiedenen Arten von Batterien, die Elektrolyse, das Galvanisieren oder das elektrolytischen Lackieren genannt.
Damit in einer Flüssigkeit ein Strom fließt und damit ein elektrischer Leitungsvorgang vor sich geht, müssen wie bei beliebigen anderen Leitungsvorgängen zwei Voraussetzungen erfüllt sein:
| Es müssen frei bewegliche (wanderungsfähige) Ladungsträger vorhanden sein: Bei Flüssigkeiten handelt es sich um positiv und negativ geladene Ionen, die in wässrigen Lösungen von Basen, Säuren und Salzen durch Dissoziation entstehen. |
| Es muss im betreffenden Raumbereich ein elektrisches Feld existieren: Das wird durch Anlegen einer elektrischen Spannung zwischen zwei Elektroden, der Anode und der Katode, erreicht. |
Der Verlauf des elektrischen Leitungsvorganges in Flüssigkeiten ist dadurch gekennzeichnet, dass
| sich Ionen in der Flüssigkeit in einer Vorzugsrichtung bewegen; die Geschwindigkeit in dieser Vorzugsrichtung wird als Driftgeschwindigkeit bezeichnet; |
die gerichtete Bewegung der Ionen durch Zusammenstöße mit den anderen Teilchen der Flüssigkeit behindert wird. Je höher die Temperatur der Flüssigkeit ist, desto stärker werden die Ionen behindert. Dabei wird elektrische Energie in thermische Energie umgewandelt. Diese thermische Energie wird in Form von Wärme an die Umgebung abgegeben. |
Dissoziation - Voraussetzung für Leitung in Flüssigkeiten
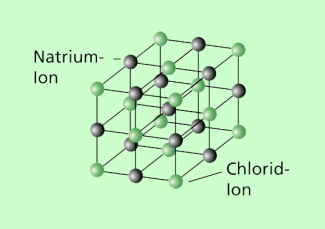
Als Dissoziation bezeichnet man die Aufspaltung von Molekülen in kleinere Bestandteile. Dies können Atome, einfache Ionen oder Ionenverbindungen sein. Die Dissoziation von Molekülen wird durch verschiedene Vorgänge ausgelöst. Sie erfolgt beim Lösen von Stoffen in Wasser oder anderen Lösungsmitteln, kann aber auch durch hohe Temperaturen, elektrische Ströme, radioaktive oder elektromagnetische Strahlung hervorgerufen werden. Nachfolgend wird als Beispiel die Dissoziation von Kochsalzkristallen (Bild 2) in Wasser näher betrachtet. Im Kristallgefüge werden die einzelnen Natrium- und Chlorionen durch die gegenseitige elektrostatische Anziehung an ihrem Platz gehalten. Dabei sind die Natriumionen positiv und die Chlorionen negativ geladen. Gelangt ein Kochsalzkristall in Wasser, dann treten die Ionen an seiner Oberfläche in Wechselwirkung mit den Wassermolekülen. Dabei wirkt sich besonders der Dipolcharakter der Wassermoleküle aus.
Darunter versteht man folgende Eigenschaft: In den Wassermolekülen sind die Wasserstoffatome und die Sauerstoffatome mit ihren gemeinsamen Bindungselektronen so verteilt, dass ein Teil des länglichen Wassermoleküls positiv, der andere Teil negativ geladen ist. Die Wassermoleküle lagern sich daher so an die Kochsalzoberfläche an, dass ihr positiv geladener Abschnitt in Richtung Chlorionen zeigt und diese weitgehend umschließt. Andere Wassermoleküle lagern sich mit ihrem negativ geladenen Teil um die Natriumionen an.
Durch die Wassermoleküle werden die von den Ionen ausgehenden elektrostatischen Kräfte abgeschwächt. Die Ionen an der Oberfläche werden dadurch nicht mehr ausreichend an das Kochsalzgitter gebunden und verlassen es. Kurz darauf umschließen die Wassermoleküle die einzelnen freien Ionen vollständig. Sie bilden eine kleine Wasserhülle um sie, die man auch Solvathülle nennt. Schritt für Schritt wird nun der ganze Kristall gelöst - er dissoziiert. Die Dissoziationsgleichung lautet in diesem Fall:
Die einzelnen Ionen sind mit ihren Solvathüllen im Wasser nahezu frei beweglich. Ausreichend durch die geordneten Wassermoleküle ihrer Solvathüllen abgeschirmt, beeinflussen sie sich - verglichen mit den Kräften im Kristallgitter - kaum noch gegenseitig.
Leitungsvorgang in Flüssigkeiten
Wir betrachten eine leitende Flüssigkeit. Solche Flüssigkeiten nennt man auch Elektrolyte. Werden nun in den Elektrolyten zwei Elektroden (mit dem positiven Pol der Gleichspannungsquelle verbundene und damit positiv geladene Anode, mit dem negativen Pol der Gleichspannungsquelle verbundene und damit negativ geladene Katode) eingebracht, so ist im Elektrolyten ein elektrisches Feld vorhanden. Unter seinem Einfluss bewegen sich die positiv und negativ geladenen Elektronen mit einer bestimmten Driftgeschwindigkeit in einer Vorzugsrichtung. Die Beweglichkeit der Ionen hängt dabei (wie bei der Beweglichkeit von Elektronen in Metallen) vom Stoff, von der Temperatur und von der elektrischen Feldstärke im betreffenden Raumbereich ab. Die Beweglichkeit von Ionen ist aber etwa um den Faktor 1/100.000 geringer als bei guten Leitern und stark von der Art der Ionen abhängig.
Die positiv geladenen Kationen wandern zur Katode, entladen sich dort und lagern sich ab oder werden als Gas freigesetzt. Die negativ geladenen Anionen wandern zur Anode, entladen sich ebenfalls und lagern sich ab oder werden als Gas freigesetzt. Der gesamte Vorgang der Ionenwanderung einschließlich der damit verbundenen stofflichen Veränderungen wird als Elektrolyse bezeichnet.
Die faradayschen Gesetze der Elektrolyse
Der englische Physiker MICHAEL FARADAY (1791-1867) entdeckte 1834 zwei grundlegende Gesetze für den Stromfluss in Elektrolyten. Ihm zu Ehren werden diese Gesetze als faradaysche Gesetze bezeichnet.
1. faradaysches Gesetz: Das erste faradaysche Gesetz macht eine Aussage über die Masse der Ionen, die an den Elektroden abgeschieden werden. Diese ist umso größer,
- je größer die transportierte Ladung Q ist und
- je größer das elektrochemische Äquivalent c ist.
Das elektrochemische Äquivalent eines Stoffes gibt an, wie viele Milligramm des Stoffes durch ein Coulomb Ladung transportiert werden.
Als Gleichung lässt sich das 1. faradaysche Gesetz folgendermaßen formulieren:
Ist die Stromstärke konstant, so lässt sich das Gesetz auch so schreiben::
Diese Beziehung wurde viele Jahre lang (bis 1948) zur Definition der Einheit für die elektrische Stromstärke genutzt: Ein Ampere ist die Stärke eines Stromes, der in einer Sekunde aus einer wässrigen Silberchloridlösung 1,118 mg Silber ausscheidet.
2. faradaysches Gesetz: Das zweite faradaysche Gesetz stellt den Zusammenhang zwischen der transportierten Ladung und den Ionen her, die diese Ladung und mit der Ladung auch Masse bewegen. Die transportierte Ladung hängt ab
- von der Stoffmenge, die zwischen den Elektroden bewegt wird,
- von der Wertigkeit der Ionen und
- von einer Konstanten, die zu Ehren von MICHAEL FARADAY den Namen FARADAY-Konstante trägt.
Als Gleichung lässt sich das 2. faradaysche Gesetz folgendermaßen formulieren:
Die FARADAY-Konstante ist das Produkt aus der Elementarladung und der AVOGADRO-Konstanten.
Bezieht man dieses Gesetz auf verschiedene Elektrolyte und setzt eine konstante Ladung Q voraus, so kann man auch formulieren:
Die durch gleiche Ladungen aus Elektrolyten abgeschiedenen Massen verhalten sich wie die chemischen Äquivalente dieser Stoffe. Es gilt:
Diese Gleichung ergibt sich, wenn man von der zuerst genannten Gleichung ausgeht und setzt:
Gleichsetzen von (1) und (2) liefert unter Nutzung der Beziehung
n = m/M die genannte Verhältnisgleichung.
Suche nach passenden Schlagwörtern
- Solvathülle
- Anionen
- Anode
- Driftgeschwindigkeit
- Berechnung
- Katode
- Beweglichkeit der Ionen
- Michael Faraday
- Ionen
- Bindungselektronen
- FARADAY-Konstante
- Kationen
- Faradaysche Gesetze
- Leitung in Flüssigkeiten
- elektrochemisches Äquivalent
- leitende Flüssigkeiten
- Elektrolyse
- Rechenbeispiel
- Elektrische Leitungsvorgänge in Flüssigkeiten
- Dissoziation
- Elektrolyte
- Kochsalzkristalle