Thermodynamische Systeme
Thermodynamische Systeme sind physikalische Systeme, in denen thermodynamische Erscheinungen und Vorgänge ablaufen. Abgegrenzt sind sie von der Umgebung durch eine Systemgrenze, die festgelegt werden muss. Wie andere physikalische Systeme kann auch ein thermodynamisches System abgeschlossen, geschlossen oder offen sein. Charakterisiert wird der Zustand eines Systems mit Zustandsgrößen, z.B. der Temperatur, dem Druck oder dem Volumen. Die Beschreibung der Vorgänge zwischen Körpern im System und auch zwischen dem System der seiner Umgebung erfolgt durch Prozessgrößen, z.B. der Wärme und der Arbeit.
In der Thermodynamik ist es üblich, von thermodynamischen Systemen zu sprechen. Damit erfolgt eine Abgrenzung zu anderen Teilbereichen der Physik, etwa zu mechanischen Systemen.
Ein thermodynamisches System ist ein durch eine Systemgrenze von seiner Umgebung abgetrennter Raumbereich, der durch Zustandsgrößen gekennzeichnet werden kann.
Solche Zustandsgrößen, die ein System kennzeichnen, sind z.B. die Temperatur, der Druck, das Volumen, die Dichte, die innere Energie, die Teilchenanzahl oder die Geschwindigkeit der Teilchen.
Die Wahl der Systemgrenze ist willkürlich. Sie erfolgt aus Gründen der Zweckmäßigkeit meist so, dass die Vorgänge im System möglichst gut überschaubar und einfach erfasst werden können. Dazu kann man ein komplexes System auch in Teilsysteme zerlegen. Über die Systemgrenze hinweg kann ein System mit der Umgebung in Wechselwirkung treten. Welche Wechselwirkungen zwischen System und Umgebung in die Betrachtungen einbezogen werden, muss jeweils eindeutig geklärt werden.
Wie andere physikalische Systeme kann auch ein thermodynamisches System abgeschlossen, geschlossen oder offen sein.
Ein abgeschlossenes thermodynamisches System ist dadurch gekennzeichnet, dass die Systemgrenze für Energie und Stoffe undurchlässig ist. Ein Beispiel dafür ist ein gut isoliertes Thermosgefäß.
Ein geschlossenes thermodynamisches System ist ein solches, bei dem über die Systemgrenze hinweg kein Stoffaustausch, aber ein Energieaustausch in Form von Wärme und Arbeit erfolgt. Beispiele dafür sind Kühlschänke oder Sonnenkollektoren.
Ein offenes thermodynamisches System ist ein System, bei dem durch die Systemgrenze hindurch sowohl Stoff- als auch Energieaustausch erfolgt. Das ist z.B. bei einem Pkw-Motor der Fall, dem Kraftstoff zugeführt wird und der Wärme und Arbeit an die Umgebung abgibt.
Stoffaustausch mit der Umgebung kann durch Größen beschrieben werden, die Stoffmengen charakterisieren, z.B. die Masse oder das Volumen.
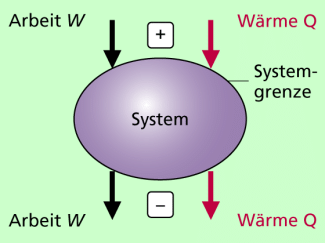
Energieaustausch mit der Umgebung wird durch die Prozessgrößen Wärme und mechanische Arbeit beschrieben. Dabei gibt es eindeutige Festlegungen bezüglich der Vorzeichen (Bild 2):
- Wird an einem System mechanische Arbeit verrichtet oder wird dem System Wärme zugeführt, so haben Arbeit und Wärme ein positives Vorzeichen. Die Energie des Systems wird größer.
- Wird von einem System mechanische Arbeit verrichtet oder gibt das System Wärme ab, so haben Arbeit und Wärme ein negatives Vorzeichen. Die Energie des Systems wird kleiner.
-
Wird zwischen einem System und seiner Umgebung Wärme oder Arbeit ausgetauscht, so ist die in der Physik übliche Vorzeichenregelung zu beachten.
Suche nach passenden Schlagwörtern
- Energieaustausch
- Mechanische Arbeit
- offenes thermodynamisches System
- Wärme
- geschlossenes thermodynamisches System
- Physikalische Systeme
- Systemgrenze
- Umgebung eines Systems
- Wechselwirkung zwischen System und Umgebung
- Zustandsgrößen eines Systems
- Thermodynamische Systeme
- abgeschlossenes thermodynamisches System
- Stoffaustausch

