Faradaysche Gesetze
Der englische Physiker und Chemiker MICHAEL FARADAY (1791-1867) entdeckte 1834 zwei grundlegende Gesetze für den Stromfluss in leitenden Flüssigkeiten (Elektrolyten). Ihm zu Ehren werden diese Gesetze als faradaysche Gesetze bezeichnet.
Der englische Physiker und Chemiker MICHAEL FARADAY (1791-1867) entdeckte 1834 zwei grundlegende Gesetze für den Stromfluss in leitenden Flüssigkeiten (Elektrolyte). Ihm zu Ehren werden diese Gesetze als faradaysche Gesetze bezeichnet.
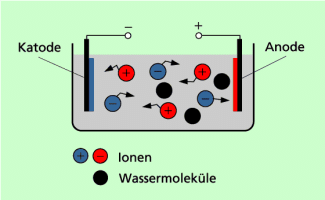
1. faradaysches Gesetz: Das erste faradaysche Gesetz macht eine Aussage über die Masse der Ionen, die an den Elektroden abgeschieden werden (Bild 1).
Diese ist umso größer,
- je größer die transportierte Ladung Q ist und
- je größer das elektrochemische Äquivalent ist.
Das elektrochemische Äquivalent eines Stoffes gibt an, wie viel Milligramm des Stoffes durch ein Coulomb Ladung transportiert werden.
Als Gleichung lässt sich das 1. faradaysche Gesetz folgendermaßen formulieren:
Ist die Stromstärke konstant, so lässt sich das Gesetz auch folgendermaßen formulieren:
2. faradaysches Gesetz: Das zweite faradaysche Gesetz stellt den Zusammenhang zwischen der transportierten Ladung und den Ionen her, die diese Ladung und mit der Ladung auch Masse bewegen. Die transportierte Ladung hängt ab
- von der Stoffmenge, die zwischen den Elektroden bewegt wird,
- von der Wertigkeit der Ionen und
- von einer Konstanten, die zu Ehren von MICHAEL FARADAY den Namen FARADAY-Konstante trägt.
Als Gleichung lässt sich das 2. faradaysche Gesetz folgendermaßen formulieren:
Die FARADAY-Konstante ist das Produkt aus der Elementarladung und der AVOGADRO-Konstanten.
Bezieht man dieses Gesetz auf verschiedene Elektrolyte und setzt eine konstante Ladung Q voraus, so kann man auch formulieren:
Die durch gleiche Ladungen aus Elektrolyten abgeschiedenen Massen verhalten sich wie die elektrochemischen Äquivalente dieser Stoffe. Es gilt:
Diese Gleichung ergibt sich, wenn man von der zuerst genannten Gleichung ausgeht und setzt:
Gleichsetzen von (1) und (2) liefert unter Nutzung der Beziehung
n = m/M die genannte Verhältnisgleichung.