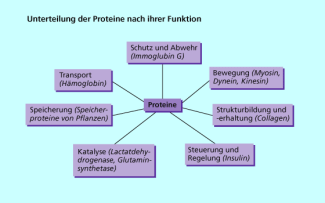
Eiweiße als Multitalente mit vielen Funktionen in der Natur
Eiweiße (Proteine) sind kompliziert gebaute makromolekulare Verbindungen, die vorwiegend oder ausschließlich aus Aminosäuren aufgebaut sind. Würde man diese Makromoleküle durch chemische Reaktionen in ihre Bausteine zerlegen, kommt man zu einem erstaunlichen Resultat. Nur 22 verschiedene Aminosäuren sind am Aufbau der Biopolymere beteiligt. Trotzdem ist ihre Vielfalt gewaltig. Im menschlichen Organismus findet man mehr als 100 000 verschiedene Eiweiße, die alle spezifische Funktionen erfüllen. Nach ihrer Funktion unterteilt man die Proteine in verscheidene Gruppen.
Aufbau von Eiweißen (Proteinen)
Eiweiße (Proteine) sind kompliziert gebaute makromolekulare Verbindungen, die vorwiegend oder ausschließlich aus Aminosäuren aufgebaut sind. Man spricht von einem Eiweiß, wenn in seinen Molekülen jeweils mehr als 100 Aminosäuren durch Peptidbindungen miteinander verknüpft sind. Ihre Vielfalt ist gewaltig. Im menschlichen Organismus findet man mehr als 100 000 verschiedene Eiweiße.
Würde man diese Makromoleküle durch chemische Reaktionen in ihre Bausteine zerlegen, kommt man zu einem erstaunlichen Resultat. Nur 22 verschiedene Aminosäuren sind am Aufbau der Biopolymere beteiligt. Diese Aminosäuren bezeichnet man als proteinogene Aminosäuren. Das bedeutet auch, dass im Organismus noch andere Aminosäuren eine Rolle spielen, diese aber nicht am Aufbau von Eiweißen beteiligt sind.
Das längste menschliche Protein besteht aus über 30 000 miteinander verknüpften Aminosäuren; bei nur 22 zur Verfügung stehenden Bausteinen muss deshalb jede der proteinogenen Aminosäure vielfach eingebaut worden sein. Die Sequenz der Aminosäuren (Art, Anzahl und Reihenfolge) bildet die Primärstruktur des Eiweißes und bedingt auch die Strukturierung im Raum (Sekundär-, Tertiär und gegebenenfalls auch Quartärstruktur) mit. Die vollständig ausgebildete Struktur des Eiweißes ist entscheidend für die Funktion im Organismus und bedingt erst die biologische Wirksamkeit des Proteins.
-
Unser Körper ist aus vielen Eiweißen aufgebaut. Dazu gehören Struktureiweiße und kontraktile Eiweiße, die unsere Bewegung ermöglichen.
Eiweiße sind Multitalente, die die unterschiedlichsten Funktionen im Organismus ausüben können (Bild 2). Sie bestimmen die Struktur jeder Zelle, wirken an Stoffwechselprozessen mit, haben wesentliche Transportfunktionen und sind Bestandteile des Immunsystems. Unter anderem deshalb sind Proteine Grundbausteine des Lebens.
Struktureiweiße
Collagen, Elastin und Keratin sind Bestandteile von Bindegewebe, Stützgewebe und Biomembranen und werden deshalb Struktureiweiße genannt. Collagen ist ein Protein, dass z. B. vor allem in Knorpeln, Knochen, Sehnen und Haut enthalten ist. Die Bildung des Collagens ist eng an das Vorhandensein von Vitamin C geknüpft. Deshalb sind eine gesunde Ernährung und eine gute Versorgung mit Vitamin C eine Grundvoraussetzung für eine schnelle Heilung bei Knochenbrüchen, Operationen und Verletzungen.
In der Kosmetik werden zunehmend collagenhaltige Produkte verwendet, die dem unaufhaltsamen Altern entgegenwirken sollen. Das Resultat ist bei entsprechenden Unterspritzungen nur für einen begrenzten Zeitraum zufriedenstellend, da das gespritzte Kollagen aus Rinderhäuten gewonnen wird und körperfremdes Eiweiß erkannt und schnell abgebaut wird, zum anderen ist das Erschlaffen der Haut auch ein durch Eiweiße gesteuerter Vorgang.
Eine weitaus angenehmere Art, vor allem tierische Collagene (als Gelatine) zu sich zu nehmen, ist der Genuss von Gummibärchen. Gelatinekapseln werden von vielen Herstellern zum Aufbau von Gelenkknorpeln, Haar, Sehnen und Bändern empfohlen. Ob wirklich durch die Ernährung auf diese Gewebe Einfluss genommen werden kann, wird immer wieder diskutiert.
-
Eiweiße (Proteine) können nach ihrer Funktion im Organismus in verschiedene Gruppen unterteilt werden.
Kontraktile Eiweiße
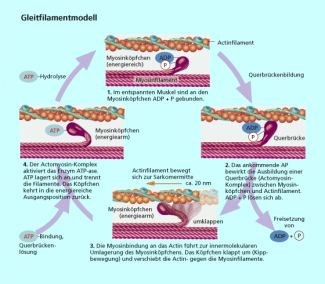
Proteine wie Actin und Myosin bewirken die Kontraktion eines Muskels. Diese und andere kontraktile Eiweiße und sind so für unsere Fähigkeit der Fortbewegung unerlässlich.
In einer Muskelzelle ist jedes zehnte Eiweißmolekül ein Actinmolekül. Dieses besteht aus einer Kette von 375 miteinander durch Peptidbindung verknüpften Aminosäureresten. Myosin ist ein Protein, das aus sechs Polypeptidketten besteht. Es wirkt als ATP-ase. Entscheidend ist, dass Myosin unter ATP-Verbrauch seine Form verändert. Actin aktiviert diese Veränderung mit und erhöht die Wirksamkeit des Myosins. Diese Zusammenspiel ist die Grundlage fast aller Bewegungen im Tierreich (Bild 3). Im Muskel sind Myosin und Actin in Filamente organisiert, sodass sich die Einzelbewegungen der Moleküle summieren, sichtbare Muskelkontraktionen und infolge dessen Bewegungen ermöglicht werden.
Enzyme
Enzyme sind Biokatalysatoren und fast ausnahmslos Proteine. Die Eiweißmoleküle ermöglichen die zahllosen biochemischen Reaktionen in den Zellen der Organismen, indem sie die Aktivierungsenergie der Ausgangsstoffe bei den biochemischen Prozessen senken, sodass die biochemischen Reaktionen zum Beispiel im menschlichen Organismus schon bei Körpertemperatur ablaufen können.
Fehlen einem Lebewesen bestimmte Enzyme, kommt es zu Stoffwechselstörungen, die bestimmte Krankheitsbilder zur Folge haben können. Beispielsweise kann bei der Phenylketonurie eine wichtige Aminosäure, Phenylalanin, nicht abgebaut werden und sammelt sich so im Organismus an. Bei der Hyperammonämie ist der Harnstoffwechsel infolge fehlender oder nicht korrekt arbeitender Enzyme gestört. Bei der Hyperlysinämie ist der Lysingehalt im Blut zu hoch, ebenfalls bedingt durch eine Störung des Stoffwechsels infolge fehlender Enzyme.
Die vielfältigen Funktionen und die Wirkungsweise von Enzymen sind in einem separaten Beitrag beschrieben.
-
Zusammenwirken von Myosin und Actin als Voraussetzung für Muskelkontraktion und Bewegung
Hormone
Hormone sind Substanzen, die in bestimmten Organen gebildet und ins Blut abgegeben werden. Sie dienen zusammen mit dem Nervensystem der Informationsübertragung zwischen Organen und Zellen, sind so interzelluläre Regulationsstoffe. Hormone wirken schon in geringster Dosierung und sind in der Medizin deshalb besonders vorsichtig und verantwortungsvoll einzusetzen. Nicht alle Hormone gehören zur Gruppe der Eiweiße, aber einige Hormone sind hier einzuordnen.
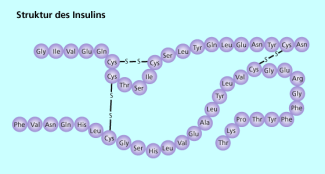
Ein sehr bekanntes, zu den Proteinen zählendes Hormon ist das Insulin. Es wird in einer Vorstufe, dem (Proinsulin), in den Langerhansschen Inseln der Bauchspeicheldrüse gebildet. Aus dieser Vorstufe entstehen zu gleichen Teilen C-Peptid, das für den menschlichen Stoffwechsel bedeutungslos ist und Insulin.
Insulin besteht aus zwei Ketten: In der A-Kette sind 21 Aminosäurereste miteinander verknüpft, in der B-Kette 30 Aminosäurereste. Verknüpft sind diese beiden Ketten durch Schwefelbrücken (Bild 4).
Gemeinsam mit den Hormonen Glucagon und Somatostatin (ebenfalls in der Bauchspeicheldrüse synthetisiert) regelt das Hormon den Glucosestoffwechsel im Körper. Allein das Insulin kann die Senkung des Blutzuckerspiegels bewirken. Es fördert die Aufnahme der Glucose in die Zellen und verhindert, dass in der Leber gespeicherte tierische Stärke zu Glucose abgebaut wird. Steigt der Blutzuckerspiegel, steigt auch die Insulinausschüttung. Dadurch sinkt der Blutzuckerspiegel.
Rund 6 Millionen Menschen leiden in Deutschland an Diabetes. Infolge eines Insulinmangels ist die Regulation des Blutzuckerspiegels empfindlich gestört und der Blutzuckerspiegel ist zu hoch. Produziert eine Bauchspeicheldrüse kein Insulin mehr, müssen menschliches oder tierisches Insulin von außen zugeführt werden, um den Blutzuckerspiegel zu senken. Solche Menschen sind Diabetiker-Typ-1 (5 % der Betroffenen Diabetiker).
Produziert die Bauchspeicheldrüse zu wenig des Hormons, erkennen die Körperzellen das Insulin nicht mehr ausreichend. Nur schwach reagieren sie auf den Botenstoff. Die Bauchspeicheldrüse produziert immer größere Mengen an Insulin, um die verminderte Insulinempfindlichkeit auszugleichen, ein zu hoher Insulinspiegel ist messbar. Die Glucose wird trotzdem nicht ausreichend verstoffwechselt, der Betroffene ist ein Diabetiker-Typ-2 (95 % der Erkrankten).
Übergewicht und Mangel an körperlicher Betätigung steigern die Insulinresistenz der Zellen. 80 bis 90 Prozent der Diabetiker vom Typ-2 sind zu schwer. Mit entsprechender Ernährung, Gewichtsreduktion und körperlicher Betätigung kann diesem Diabetestyp vorgebeugt werden bzw. die Auswirkungen verringert werden.
-
In dieser vereinfachten Darstellung der Insulinstruktur sind die Schwefelbrücken zwischen den Cystein-Resten hervorgehoben.
Transporteiweiße
Eiweiße sind am Transport von Sauerstoff, Hormonen, Fetten, Metall-Ionen, Medikamenten und Elektronen (z. B. bei der Fotosynthese) im Organismus beteiligt. Ein wichtiges Transportprotein ist das Hämoglobin (Hb). Der rote Blutfarbstoff ist ein wichtiger Bestandteil der roten Blutkörperchen (Erythrozyten) und hat die Aufgabe, Sauerstoff in der Lunge aufzunehmen und bis zu jeder Zelle zu transportieren. Die Sauerstoffabgabe erfolgt zwischen Kapillaren und Zellen. Dabei wird gleichzeitig Kohlenstoffdioxid an Hämoglobin gebunden und in den Blutzellen bis zur Lunge befördert. Hier erfolgt erneut ein Gasaustausch, diesmal zwischen Kapillaren und Lungenbläschen.
Hämoglobin (Hb) ist ein sehr großes Eiweißmolekül (Bild 5). Es besteht zu 94 Prozent aus Globin (4 Polypeptidketten) und zu 6 Prozent aus der eisen(II)-ionenhaltigen Hämgruppe. Dort wird der Sauerstoff „angedockt“. Die gesamte Hämoglobin-Menge eines Erwachsenen beträgt etwa 650 Gramm. Da die roten Blutkörperchen nur eine begrenzte Lebensdauer haben, werden jeden Tag neue Blutkörperchen im roten Knochenmark gebildet und mit ihnen auch Hämoglobin. Im Zusammenhang damit werden täglich 57 Gramm Hämoglobin in unreifen roten Blutkörperchen produziert.
Die Hämoglobin-Konzentration (Hb) ist ein entscheidendes Merkmal zur Diagnostik von Anämien (zu wenig rote Blutkörperchen) und anderen Erkrankungen des Blutes. Unterschreitet die Hb-Konzentration folgende Grenzwerte, kann von einer Anämie ausgegangen werden:
| Männer: | 13 - 18 g/dl | |
| Frauen: | 11 - 16 g/dl | |
| Kinder bis 6 Jahre: | 10 - 11 g/dl | |
| Kinder 6 bis 14 Jahre: | 11 - 12 g/dl | |
-
Darstellung der räumlichen Struktur (Quartärstruktur) von Hämoglobin
Plasmaeiweiße
Plasmaeiweiße sind im Blutplasma enthaltene Eiweiße wie Fibrinogen, Albumin und Globuline.
Fibrinogen ist für die Blutgerinnung verantwortlich. Bei einer Verletzung wird Fibrinogen unter dem Einfluss von Thromboplastin aus dem verletzten Gewebe in Fibrinfäden umgewandelt. Diese wirken beim Wundverschluss mit.
Bei den Globulinen unterscheidet man zwischen alpha-, beta- und gamma-Globulinen. Sie werden hauptsächlich in der Leber gebildet und sind im reinen Wasser unlöslich, lösen sich aber im Blutplasma, das eine bestimmte Konzentration an gelösten Salzen (insbesondere an Kochsalz) aufweist). Globuline haben sowohl Transportfunktion, wirken bei der Immunabwehr und der Blutgerinnnung mit.
Einige Globuline können Stoffe an sich binden und so im Blut transportieren oder durch dieses Andocken den Abbau der jeweiligen Substanz verzögern. Das kann die Wirkung eines Medikaments entscheidend beeinflussen. Außerdem ist untersucht worden, dass bestimmte Giftstoffe durch diesen Effekt nicht oder nur unzureichend zerlegt und ausgeschieden werden können.
Wird unser Körper von Bakterien, Viren, Pollen, Pilzen oder anderen Angreifern attackiert, muss das Immunsystem reagieren. Dazu muss nach dem Eindringen eine Unterscheidung in Freund und Feind getroffen werden. Sind die Feinde ausgemacht und kontaktiert, bilden die weißen Blutkörperchen körpereigene Eiweiße, die Immunglobuline, auch Antikörper genannt. Die Bekämpfung kann beginnen. Diese Antikörper sind im Blut, in Körpersekreten und Gewebsflüssigkeiten nachweisbar. So wichtig diese körpereigene Abwehr von Fremdeiweißen der Krankheitskeime ist, kann diese Immunreaktion bei Organtransplantationen den Erfolg der Operation und somit die Lebensrettung verhindern. Deshalb sollen Organ und Empfänger maximale Übereinstimmungen aufweisen, damit das lebenserhaltende Organ nicht als Feind erkannt und abgestoßen wird. Außerdem muss der Patient oft lebenslänglich mit einer medikamentös unterdrückten Immunabwehr leben.
Albumin bildet den mengenmäßig größten Anteil am Plasmaeiweiß (bis zu 60 %). Eine Hauptaufgabe des Albumins besteht darin, an der Flüssigkeitsverteilung im Organismus zu wirken, beispielweise die Wassereinlagerung zwischen den Zellen zu verhindern. Mangelt es dem Körper durch unzureichende Ernährung an Eiweißen, können sie diese Funktion nicht mehr erfüllen und es kommt zur Ausbildung von Ödemen, Wasseransammlungen im Gewebe. Mangelernährte Kinder in Entwicklungsländern weisen mit ihren auffällig dicken Bäuchen solche Hungerödeme auf. Weitere Krankheitszeichen bei Eiweißmangel sind Muskelschwäche, Fettleber und Wachstumsstörungen. Außerdem erfüllt Albumin ebenfalls Transportfunktion und nicht zuletzt dient es als Reserveeiweiß.

