Fließgleichgewicht und thermodynamisches Gleichgewicht
Der Begriff „Fließgleichgewicht“ wurde von dem österreichisch-kanadischen Biologen LUDWIG VON BERTALANFFY (1901-1972) erstmalig geprägt. Auch als dynamisches Gleichgewicht bezeichnet, beschreibt die Begrifflichkeit den Gleichgewichtszustand offener Systeme, wobei ein ständiger Austausch von Masse und Energie stattfindet. Im dynamischen Gleichgewicht sind alle am Stoffwechsel beteiligten Verbindungen in der nahezu gleichen Konzentration vorhanden.In einem Ökosystem beispielsweise hält der Energiefluss der Sonne die Stoffkreisläufe (Kohlenstoff- und Stickstoffkreislauf) in Gang. Auf organismischer Ebene bestehen Fließgleichgewichte durch Stoffaustausch zwischen einzelnen Organen eines Organismus und zwischen Organismen mit ihrer Umwelt. Auf molekularer Ebene stellen sich Fließgleichgewichte bei den biochemischen Reaktionsketten der Stoffwechselwege ein.
Organismen leben von Freier Enthalpie:
Liegt eine chemische Reaktion vom vor, stellt sich nac h einer gewissen Zeit ein Gleichgewicht zwischen den Ausgangsstoffen A und B und den Endprodukten C und D ein. Seine Lage wird durch die thermodynamische Gleichgewichtskonstante K angegeben. Danach ist
wobei c(A) ... c(D) die Konzentrationen der Stoffe in Mol/pro Liter darstellen, die sich im Gleichgewicht eingestellt haben. Die Gleichgewichtskonstante K gibt an, wie weit das System vom Gleichgewichtszustand entfernt ist. Sie wird von der Konzentration der Stoffe bestimmt.
Je weiter die tatsächlichen Konzentrationen von den Konzentrationen des im Gleichgewicht befindlichen Systems entfernt sind, umso energiereicher ist das System. Das bedeutet für die Reaktion, dass umso mehr Energie freigesetzt werden kann, je weiter das System vom Gleichgewicht entfernt ist. Diese Energie wird Freie Enthalpie G genannt. Ihre Maßeinheit ist kJ/mol.
-
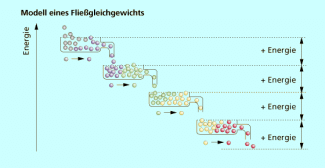
Modell eines Fließgleichgewichts
Freie Enthalpie
Wird bei einer Reaktion Energie frei, dann ist negativ. Die Reaktion verläuft exergonisch (Energie freisetzend). Ist positiv, verläuft die Reaktion endergonisch, d. h. unter Energieaufnahme. Die Reaktionen im Gleichgewicht laufen so lange ab, bis Null ist.
T = absolute Temperatur
R = Gaskonstante
Nur ein System, das sich auf ein Gleichgewicht einstellt, kann Energie freisetzen. Wenn der Gleichgewichtszustand erreicht ist, ist die Freie Enthalpie gleich Null.
Fließgleichgewicht
Durch ständigen Stoffaustausch mit der Umwelt wird verhindert, dass sich ein Gleichgewicht der Reaktionen einstellt. Das von der lebenden Zelle aufrecht erhaltene Ungleichgewicht wird als Fließgleichgewicht bezeichnet. Es ist in der Abbildung modellhaft dargestellt.
Eine lebende Zelle stellt damit ein energetisch offenes System dar. Sie steht mit ihrer Umwelt in einem ständigen Austausch von Stoffen und Energie. Theoretische Grundlage solcher Vorgänge ist nicht die klassische Thermodynamik sondern die von LARS ONSAGER (1903-1976) 1931 begründete Nichtgleichgewichts-Thermodynamik. Aus ihr lässt sich ableiten, dass Leben nur fern vom thermodynamischen Gleichgewicht existieren kann. Dieser Zustand wird durch den ständigen Fluss von Stoffen und Energie aufrecht erhalten und ist damit wesentliches Merkmal des Lebens.

