Freiwilligkeit chemischer Reaktionen
Für chemische Prozesse sind im Wesentlichen zwei Triebkräfte verantwortlich: Zum einen ist dieses die Energieänderung bei der Reaktion, beschrieben durch die Reaktionsenthalpie Die andere ist die Tendenz, freiwillig von einem geordneten zu einem ungeordneten Zustand, welcher durch die Größe Entropie beschrieben wird, überzugehen. Die Kombination dieser beiden Größen zu einer neuen Größe, der freien Enthalpie erlaubt es dem Chemiker, den Reaktionsablauf durch Wahl geeigneter Reaktionsparameter, wie Druck, Temperatur, Zusammensetzung in seinem Sinne zu beeinflussen. Die freie Standardreaktionsenthalpie verbindet die chemische Thermodynamik mit der Gleichgewichtskonstante K aus dem Massenwirkungsgesetz.
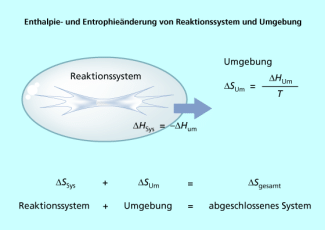
Nach dem 2. Hauptsatz der Thermodynamik muss die Entropie in einem abgeschlossenen System zunehmen, damit ein Prozess freiwillig stattfinden kann:
Da hier ein abgeschlossenes System betrachtet wird, kann weder Energie (in Form von Wärme oder Arbeit) noch Materie mit der Umgebung ausgetauscht werden. Chemische Reaktionen finden im Allgemeinen in offenen oder geschlossenen Systemen statt. Deshalb muss man sich einer Hilfskonstruktion bedienen, um Aussagen zur Freiwilligkeit chemischer Reaktionen zu machen.
In einem Gedankenexperiment bildet das eigentliche Reaktionssystem zusammen mit seiner viel größeren Umgebung ein neues zusammengesetztes abgeschlossenes System vor. Für einen freiwilligen Prozess in diesem zusammengesetzten abgeschlossenen System gilt nach dem 2. Hauptsatz (Bild 1):
Des weiteren folgt aus der Definition der Entropie bei konstantem Druck und konstanter Temperatur:
Da der Betrag der zwischen dem Reaktionssystem und seiner Umgebung ausgetauschten Enthalpie gleich ist ergibt sich schließlich folgende Gleichung:
Mit dieser Beziehung wird gleichzeitig ein mathematisches Kriterium für die Freiwilligkeit einer chemischen Reaktion bei konstantem Druck und konstanter Temperatur gegeben. Diese Formulierung bietet den Vorteil, dass zur Bestimmung der gesamten Entropieänderung nur die Größen des jeweiligen Systems bestimmt werden müssen. Aus praktischen Gründen wurde von J. W. GIBBS für das Produkt eine neue Zustandsfunktion, die freie Enthalpie G (oder auch Gibbs-Enthalpie), eingeführt:
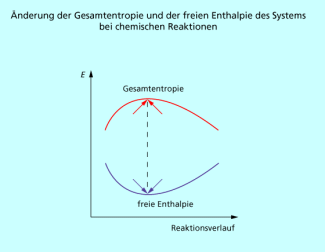
In Übereinstimmung mit dem 2. Hauptsatz der Thermodynamik und unter Berücksichtigung der Tatsache, dass die absolute Temperatur nur positiv ist ergibt sich als neues Kriterium für freiwillige Prozesse: Eine chemische Reaktion läuft bei konstantem Druck und konstanter Temperatur freiwillig ab, wenn die freie Enthalpie kleiner Null ist (Bild 2).
Die freie Standardreaktionsenthalpie
Die freie Standardreaktionsenthalpie ist die Änderung der molaren freien Enthalpie des Reaktionssystems für den Übergang der Edukte in ihren Standardzuständen zu den Produkten in ihren Standardzuständen:
Die absoluten Werte der freien Reaktionsenthalpie können experimentell nicht bestimmt werden, da es unmöglich ist, absolute Enthalpiewerte zu bestimmen.
Deshalb berechnet man die freie Standardreaktionsenthalpie mit der GIBBS-HELMHOLTZ-Gleichung aus der Standardreaktionsenthalpie und der Standardreaktionsentropie:
Diese beiden Zustandsgrößen sind sehr einfach über die in einschlägigen Tafelwerken tabellierten Standardbildungsenthalpien und die absoluten Entropien zugänglich (Rechenbeispiel).
Die freie Reaktionsenthalpie und die Zusammensetzung des Reaktionsgemisches
Die freie Standardreaktionsenthalpie ist definiert für einen sehr spezifischen Typ einer chemischen Änderung: ausgehend von den reinen Edukten zu den reinen Produkten in ihren jeweiligen Standardzuständen unter den Bedingungen eines konstanten Druckes und einer konstanten Temperatur. Ein negativer Wert von bedeutet somit, dass die entsprechende Reaktion von den reinen Edukten zu den reinen Produkten freiwillig abläuft.
Die Chemie ist generell stärker daran interessiert, dass eine chemische Reaktion bei einer beliebigen Zusammensetzung des Reaktionsgemisches freiwillig abläuft. Zum Beispiel ist für die Bildung von Iodwasserstoff aus den Elementen positiv:
Diese Reaktion läuft scheinbar bei 25 °C nicht freiwillig ab. Aber im Experiment reagieren Wasserstoff und Iod miteinander und im Reaktionsgemisch finden sich Anteile sowohl der Edukte als auch der Produkte. Folglich existiert eine spezifische Zusammensetzung des Gemisches, die eine niedrigere freie Enthalpie aufweist als die reinen Edukte oder die reinen Produkte.
Zur Identifizierung des Stoffgemisches mit der niedrigsten freien Enthalpie wird die freie Reaktionsenthalpie eingeführt. Diese Größe ist im Gegensatz zur freien Standardreaktionsenthalpie eine konzentrationsabhängige Größe. Sie bezieht sich auf die Umwandlung der Edukte in die Produkte in einer Mischung mit definierter Zusammensetzung.
Freie Reaktionsenthalpie und chemisches Gleichgewicht
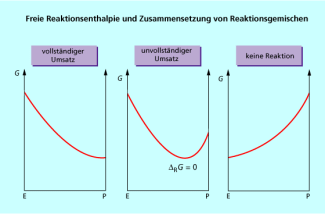
Da sich die Konzentrationen während einer chemischen Reaktion fortlaufend ändern, wird sich auch solange ändern, bis ein Minimum der freien Enthalpie (G) erreicht ist (Bild 4). Dieses kann sich vollständig auf der Seite der Edukte (E) befinden, dann würde keine Reaktion erfolgen. Liegt das Minimum vollständig auf der Seite der Produkte (P), bleibt durchgehend negativ und die Edukte werden vollständig zu den Produkten umgesetzt.
Das Minimum kann aber auch irgendwo zwischen diesen beiden Extremen liegen (mittlere Abb. Bild 4). In diesem Fall läuft die Reaktion nur bis zum Minimum, bei dem ist. Es erfolgt nur ein unvollständiger Stoffumsatz, da für jede weitere Änderung der Zusammensetzung ist. In diesem Zustand minimaler freier Enthalpie befindet sich das Reaktionssystem im chemischen Gleichgewicht .
Freie Standardreaktionsenthalpie und Gleichgewichtskonstante
Die freie Reaktionsenthalpie ergibt sich aus den freien Enthalpien der Komponenten im Reaktionsgemisch für eine allgemeine Reaktion nach folgender Gleichung:
Im chemischen Gleichgewicht findet keine Änderung der Zusammensetzung des Reaktionsgemisches statt. In diesem Zustand ist Q gleich der Gleichgewichtszusammensetzung entsprechend der Gleichgewichtskonstanten K. Da im Zustand des Minimums der freien Enthalpie ist, ergibt sich folgende Beziehung:
Diese Gleichung erlaubt Voraussagen zur Freiwilligkeit chemischer Reaktionen durch Berechnung der Gleichgewichtskonstanten aus tabellierten Werten. Der Zusammenhang verknüpft die thermodynamische Zustandsgröße freie Standardreaktionsenthalpie mit der Gleichgewichtskonstanten K aus dem Massenwirkungsgesetz. Damit stellt sie eine der bedeutendsten Beziehungen der chemischen Thermodynamik und für die allgemeine Beschreibung von chemischen Reaktionen dar (Bild 5).