Kohlenstoff Verbindungen
Kohlenstoff als Element der IV. Hauptgruppe bildet fast ausschließlich polare Atombindungen zu anderen Partnern aus. Dabei entsteht eine Vielzahl von Molekülverbindungen, angefangen von den Kohlenwasserstoffen über die ungeheure Vielfalt der anderen organischen Verbindungen bis hin zu den anorganischen Kohlenstoffoxiden. Kohlenstoffverbindungen spielen eine wichtige Rolle in der Natur (z. B. Kohlenhydrate, Fette und Eiweiße als Grundbausteine des Lebens), in der Umweltchemie (z. B. das Treibhausgas Kohlenstoffdioxid), im Alltag (z. B. organische Säuren als Konservierungsmittel) und in der Technik (z. B. Erdölprodukte oder Werkstoffe).
Kohlenstoff ist ein Element der IV. Hauptgruppe. Das Kohlenstoffatom besitzt 6 Protonen und meist 6 Neutronen im Atomkern sowie 6 Elektronen in der Atomhülle. Auf der ersten Schale befinden sich zwei und auf der zweiten Schale vier Elektronen. Diese vier Elektronen der äußeren Schale nennt man Außenelektronen.
Um eine stabile Elektronenanordnung, die Achterschale des Neons, zu erreichen, muss ein Kohlenstoffatom vier Elektronen von Bindungspartnern aufnehmen. Alternativ würde durch Abgabe von 4 Elektronen eine abgeschlossene Schale erreicht werden. Beides ist energetisch ungünstig, daher bildet Kohlenstoff Atombindungen aus, um das Elektronenoktett zu erreichen. Wie alle Elemente der 2. Periode des PSE kann Kohlenstoff nur maximal vier Atombindungen eingehen.
Modifikationen
Modifikationen sind verschiedene Erscheinungsformen ein und desselben Stoffs. Modifikationen eines Elements bestehen aus den gleichen Atomen, haben aber durch unterschiedliche Anordnung der Atome (Struktur), unterschiedliche physikalische und z. T. auch chemische Eigenschaften.
Kohlenstoff kommt in der Natur in mehreren Modifikationen, als Grafit, Diamant oder Fullerene mit sehr verschiedenen Eigenschaften vor.
Eigenschaften der Modifikationen des Kohlenstoffs | ||
| Diamant | Grafit | Fulleren (60) |
| farblos, kristallin, durchsichtig, stark lichtbrechend, sehr hart, nicht elektrisch leitfähig | grauschwarz, blättrig, metallisch glänzend, sehr weich, parallel zu den Schichten elektrisch leitfähig | dunkelbraun, pulverförmig, geringere Dichte als Diamant und Grafit, nicht elektrisch leitfähig |
Die Ursache der verschiedenen Eigenschaften ist die unterschiedliche Struktur der 3 Kohlenstoffmodifikationen.
Im Grafit sind die Kohlenstoffatome wabenartig angeordnet. Sie bilden „Wabennetze“, die in vielen ebenen Schichten übereinanderliegen. Innerhalb der Sechseckebenen besitzt jedes Kohlenstoffatom nur drei Bindungspartner. Das vierte Außenelektron ist nicht in einer Atombindung fest gebunden und kann sich deshalb frei durch das Gitter bewegen. Diese beweglichen Elektronen sind die Ursache für die elektrische Leitfähigkeit und die tiefschwarze Farbe des Grafits.
Die Wechselwirkung zwischen den einzelnen Schichten ist relativ schwach, sodass Grafit relativ weich ist und sogar als Schmiermittel eingesetzt werden kann.
-
Struktur von Grafit
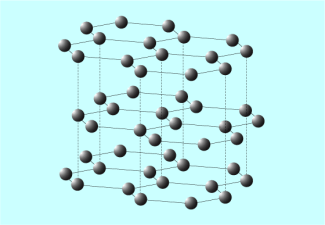
Anders als im Grafit ist im Diamant jedes Kohlenstoffatom mit vier weiteren Kohlenstoffatomen verbunden. Alle vier Außenelektronen sind an Atombindungen beteiligt, und alle Atome sind gleich weit voneinander entfernt. Je vier Atome bilden regelmäßige Tetraeder, die untereinander zu einer sehr stabilen Gitterstruktur verknüpft sind. Die stabilen Bindungen im regelmäßigen Kristallgitter sind der Grund für die extreme Härte des Diamanten. Da die Außenelektronen alle an Atombindungen beteiligt sind, kann Diamant den elektrischen Strom nicht leiten und ist ein Isolator.
-
Struktur von Diamant
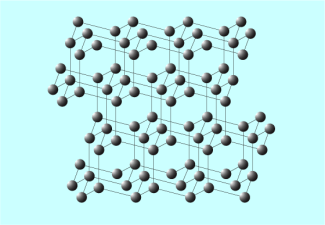
Fullerene sind selten auftretende Modifikationen des Kohlenstoffs. Sie bestehen aus Molekülen mit vielen Kohlenstoffatomen, deren Struktur an einen Fußball erinnert. In der Natur wurden Fullerene in Trümmern von Meteoriten und im Weltraum nachgewiesen. Sie wurden erst 1985 durch die amerikanischen Chemiker R. CURL, H. KROTO und R. SMALLEY entdeckt, die für diese Entdeckung den Nobelpreis erhielten.
Reaktionen des Kohlenstoffs
Kohlenstoff kann sowohl mit elektropositiveren (z. B. Wasserstoff) als auch mit elektronegativeren Partnern (z. B. Sauerstoff) Verbindungen bilden. Mit seiner Fähigkeit vier stabile Atombindungen einzugehen ist Kohlenstoff der wichtigste Bestandteil der unzähligen organischen Verbindungen und somit Grundbaustein des Lebens.
Außer bei den salzartigen Carbiden bildet Kohlenstoff in allen seinen Verbindungen polare Atombindungen aus.
-
Struktur eines Fullerens
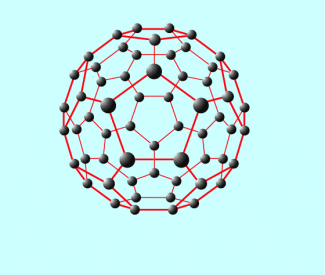
Reiner Kohlenstoff ist jedoch relativ reaktionsträge, sodass nur wenige Verbindungen direkt aus dem Element hergestellt werden können.
Mit Sauerstoff verbrennt Kohlenstoff zu den Oxiden. Je nachdem, wie viel Sauerstoff zur Verfügung steht, entsteht Kohlenstoffmonooxid oder Kohlenstoffdioxid.
-
Vorkommen und Verwendung von Kohlenstoff

Die Verbrennung von Kohlenstoff liefert neben der Verbrennung von Kohlenwasserstoffen die Energie für viele industrielle Prozesse, angefangen vom Wärmekraftwerk bis zum Hochofenprozess.
Bei Raumtemperatur reagiert Kohlenstoff nur mit dem starken Oxidationsmittel Fluor. Kohlenstoff selbst ist zwar ein starkes Reduktionsmittel, muss aber für die meisten Reaktionen erst aktiviert werden, sodass diese entweder bei hohen Temperaturen oder in Gegenwart eines Katalysators ablaufen.
Kohlenstoff-Wasserstoff-Verbindungen
Kohlenwasserstoffe sind Molekülverbindungen, die ausschließlich aus den Elementen Kohlenstoff und Wasserstoff bestehen. Je nach Verknüpfung der Kohlenstoffatome unterscheidet man zwischen ketten- und ringförmigen bzw. gesättigten und ungesättigten Kohlenwasserstoffen.
Aufgrund der verschiedenen Möglichkeiten der Anordnung der Kohlenstoff- und Wasserstoffatome gibt es eine riesige Anzahl verschiedener Kohlenwasserstoffe. Trotz ihrer unterschiedlichen Struktur sind sie die einfachsten organischen Kohlenstoffverbindungen; alle anderen organischen Verbindungen können daraus abgeleitet werden.
Das Reaktionsverhalten der Kohlenwasserstoffe ist in den Beiträgen über Alkane, Alkene und Alkine auf der DVD ausführlich beschrieben.
Der einfachste Vertreter der Kohlenwasserstoffe ist Methan. Das Methanmolekül besteht aus einem Kohlenstoff- und vier Wasserstoffatomen. Die Wasserstoffatome bilden ein regelmäßiges Tetraeder, in dessen Zentrum sich das Kohlenstoffatom befindet. Die stabile Tetraederstruktur ist in der Chemie sehr häufig und tritt sowohl bei den Alkanen als auch in anorganischen Festkörpern, z. B. im Diamant auf.
Methan ist ein farbloses, leicht brennbares Gas, das mit Luft explosive Gemische bildet. Es ist Hauptbestandteil des Erdgases. Auch in Kohlelagerstätten ist Methan in mehr oder weniger großen Mengen in der Kohle eingeschlossen als sogenanntes Grubengas. Bei unzureichenden Sicherheitsmaßnahmen kann es dann folgenschwere Untertage- Explosionen in Bergwerken verursachen.
Es hat große technische Bedeutung als Heizgas, als ökologische Alternative zu herkömmlichen Treibstoffen und als Synthesegas in der chemischen Industrie.
Kohlenstoff-Sauerstoff-Verbindungen
Die bekannten Oxide des Kohlenstoffs sind Kohlenstoffmonooxid und Kohlenstoffdioxid. Zusammen mit den Kohlenstoff-Schwefel-Verbindungen (Kohlenstoffdisulfid, ) bilden die Oxide, die Kohlensäure und die Carbonate die Gruppe der anorganischen Kohlenstoffverbindungen.
-
Einteilung der Kohlenwasserstoffe
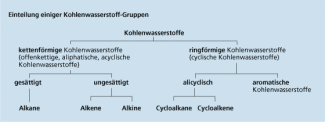
Kohlenstoffmonooxid ist eine Molekülverbindung. Das Molekül besteht aus einem Atom Kohlenstoff und einem Atom Sauerstoff, die durch eine Dreifachbindung miteinander verbunden sind.
Kohlenstoffmonooxid ist ein farbloses und geruchloses Gas und leichter als Luft. Es ist außerordentlich giftig, denn Kohlenstoffmonooxid wird vom roten Blutfarbstoff Hämoglobin stärker gebunden als Sauerstoff. Der Sauerstofftransport des Bluts wird dadurch behindert und der Mensch, der das Gas einatmet, erstickt. Es entsteht bei Verbrennungen unter Sauerstoffmangel (Rauchgasvergiftung bei Schwelbränden in Wohnungen).
Kohlenstoffmonooxid ist wenig wasserlöslich und verbrennt mit bläulicher Flamme zu Kohlenstoffdioxid.
Diese Wirkung des Kohlenstoffmonooxids als Reduktionsmittel wird z. B. im Hochofenprozess zur Gewinnung von Eisen aus dem Eisenoxid genutzt:
Kohlenstoffmonooxid wird jedoch selbst von Wasserstoff reduziert. Die Reaktion nennt man Hydrierung und stellt bietet die Möglichkeit, industriell Methanol herzustellen.
In der Technik benutzt man das Kohlenstoffmonooxid als Synthesegas im Gemisch mit Wasserstoff. Dabei kann man je nach Katalysator und Reaktionsbedingungen verschiedene Produkte herstellen.
-
Strukturformel (mit Formalladungen) und Kalottenmodell des Kohlenstoffmonooxidmoleküls
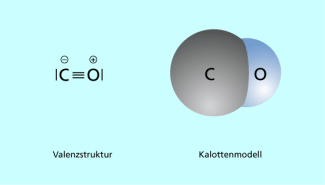
Auch Kohlenstoffdioxid ist eine Molekülverbindung, in der die Atome durch polare Atombindungen verbunden sind.
Kohlenstoffdioxid ist ein farb- und geruchloses Gas, das schwerer als Luft ist. Das Gas ist nicht brennbar und wirkt erstickend. Daher dient es beim Schweißen als Schutzgas und ist häufig in flüssiger Form in Feuerlöschern (Schaumlöschern) enthalten. Es kann unter Druck zu einer farblosen Flüssigkeit verdichtet werden, die bei Abkühlung fest wird („Trockeneis“). Während dieses feste Kohlenstoffdioxid zur Kühlung von Transportgut eingesetzt wird, dient es gasförmig (Kohlenstoffdioxidbegasung) in Gewächshäusern der Ertragssteigerung bei Fotosynthese betreibenden Pflanzen.
Darüber hinaus ist Kohlenstoffdioxid Ausgangsstoff zur Herstellung von Soda und Harnstoff. Bei der Reaktion mit Wasser entsteht in geringen Mengen Kohlensäure.
„Kohlensäure“ wird in Form von Kohlenstoffdioxid Getränken zugesetzt, um deren Geschmack und die Haltbarkeit zu verbessern. In wässriger Lösung werden nur 0,1 % des Kohlenstoffdioxids in die Säure umgewandelt, 99,9 % liegen als physikalisch gelöstes Oxid vor. Das Kohlenstoffdioxid entweicht nach dem Öffnen der Flaschen als kleine Gasbläschen.
Beim Nachweis des Kohlenstoffdioxids nutzt man seine Reaktion mit Hydroxidlösungen von Metallen der II. Hauptgruppe. In einer Fällungsreaktion entstehen dabei schwer lösliche Carbonate.
Im Labor wird Bariumhydroxidlösung (Barytwasser) oder Calciumhydroxidlösung verwendet.
-
Strukturformel (mit Formalladungen) und Kalottenmodell des Kohlenstoffdioxidmoleküls
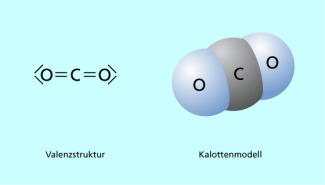
Kohlenstoffdioxid wird durch Reaktionen von Carbonaten mit stärkeren Säuren wieder freigesetzt.
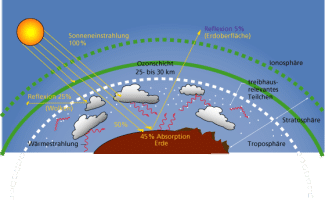
In der atmosphärischen Luft sind etwa 0,039 Vol% enthalten. Das Gas wirkt in der Atmosphäre als „Wärmespeicher“ und hat eine große Bedeutung für das Temperaturgleichgewicht auf der Erde. Diesen Effekt nennt man Treibhauseffekt (Bild10). Durch die Verbrennung fossiler Brennstoffe ist der -Gehalt der Atmosphäre in den letzten Jahrzehnten erheblich gestiegen, was zu einer künstlichen Verstärkung des natürlichen Treibhauseffekts führt.
-
Treibhauseffekt
Kohlensäure ist eine schwache Säure, die nur in wässriger Lösung vorliegt. Die dazugehörigen Salze heißen Carbonate. Zahlreiche Carbonate (z. B. Marmor: , Dolomit: , Siderit: ) kommen in der Natur vor. Als zweibasische Säure bildet die Kohlensäure auch Hydrogencarbonate, z. B. NaHCO3 (Natriumhydrogencarbonat, Natron), wobei in wässriger Lösung ein Gleichgewicht zwischen Carbonat, gelöstem Kohlenstoffdioxid und Hydrogencarbonat vorliegt.
CO3 2- + CO2 + H2O 2 HCO-
Dieses Gleichgewicht spielt bei Anwesenheit von Calcium-Ionen im Wasser, beispielsweise im Trinkwasser, eine wichtige Rolle. Unter Normalbedingungen liegt im Wasser Hydrogencarbonat vor und Calciumhydrogencarbonat ist gut löslich.
Bei Erwärmen entweicht aber gelöstes Kohlenstoffdioxid aus dem Wasser, das Gleichgewicht wird damit auf die linke Seite verschoben. Calciumcarbonat ist aber schwer löslich und fällt dann als sogenannter Kesselstein aus. Das ist die Carbonat-Härte des Wassers.
Aus der Luft aufgenommenes Kohlenstoffdioxid führt dazu, dass der Regen auch ohne andere „saure“ Gase einen pH-Wert von etwa 5,5 hat. Wenn dieses Regenwasser im Gebirge in Kalkstein eindringt, entsteht lösliches Calciumhydrogencarbonat.
Betritt man eine Tropfsteinhöhle, ist man von der Formenvielfalt der Gebilde beeindruckt. Tropfsteine in den Höhlen entstanden durch sehr langsame Auflöse- und Ausfällungsprozesse von Kalkstein. Im Regenwasser wird Kohlenstoffdioxid aus der Luft gelöst. Dabei entsteht in geringem Maß Kohlensäure . Wenn das schwach saure Regenwasser durch porösen Kalkstein sickert, bildet sich leicht lösliches Calciumhydrogencarbonat.
Wenn dann aus dem an der Decke einer Höhle hängenden Tropfen das Wasser wieder verdunstet, bildet sich das schwer lösliche Calciumcarbonat zurück in Form der hängenden Stalaktiten. Verdunstet das Wasser an der Auftropfstelle am Boden, wachsen die Stalagmiten nach oben.
Carbonate werden in großem Umfang technisch genutzt, Calciumcarbonat unter anderem als Zuschlag beim Hochofenprozess, zur Herstellung von Branntkalk (CaO) für die Baustoffindustrie, für die Herstellung von Zement und Glas. Zur Herstellung von Glas wird auch Natriumcarbonat benötigt. Verschiedene Metalle (Eisen, Zink) kommen in Form der Carbonate als Erze vor und werden aus diesen gewonnen.

