Brennstoffzellen
Die Brennstoffzelle ist ein Spezialfall eines galvanischen Elements, bei dem chemische Energie direkt in elektrische Energie umgewandelt wird. Während sich bei Batterien und Akkumulatoren die an den chemischen Reaktionen beteiligten Materialien allmählich verbrauchen, werden bei der Brennstoffzelle die Ausgangsstoffe und Produkte der Reaktion kontinuierlich zu- und abgeführt. Betrieben wird sie üblicherweise mit Wasserstoff und Sauerstoff. Ein einzelnes Element einer typischen Brennstoffzelle liefert eine Gleichspannung von knapp einem Volt. Praktische Ausführungen arbeiten mit Hintereinanderschaltungen vieler solcher Elemente. Man unterscheidet je nach Betriebstemperatur Nieder-, Mittel- und Hochtemperaturbrennstoffzellen.
Gegenwärtig ist die Entwicklung leistungsfähiger Brennstoffzellen ein Schwerpunkt der technischen Forschung.
Die Brennstoffzelle - eine neue Energiequelle
Die Brennstoffzelle wurde bereits 1839 von Sir WILLIAM ROBERT GROVE (1811-1896) erfunden, jedoch erst nach dem Zweiten Weltkrieg bis zur Praxisreife gebracht. Die ersten Anwendungen waren die Stromversorgungen in den bemannten Raketen des amerikanischen Gemini- und Apollo-Programms in den 60ger Jahren des 20. Jahrhunderts. Bis zum Jahr 2010 wird der Brennstoffzelle ein großes Marktpotenzial, zum Beispiel als Fahrzeugantrieb und als wesentliche Komponente zur Stromerzeugung in Heizkraftwerken, vorausgesagt.
Historisches
Die Stromerzeugung in Batterien und Akkumulatoren hat ihre historischen Wurzeln in den berühmten Reizversuchen mit Froschschenkeln und elektrisierten Metallen des italienischen Arztes und Naturforschers LUIGI GALVANI (1737-1798). Deren korrekte Erklärung lieferte der italienische Physiker ALESSANDRO VOLTA (1745-1827), der damit die Elektrochemie begründete. In der ersten Hälfte des 19. Jahrhunderts wurden verschiedene galvanische Elemente konstruiert, denen allen gemeinsam ist, dass sie bei einer chemischen Reaktion frei werdende chemische Energie in elektrische Energie umwandeln. 1839 erfand der britische Physiker und Jurist Sir WILLIAM ROBERT GROVE (1811-1896) die Brennstoffzelle, bei der die Reaktionen von Wasserstoff und Sauerstoff an Platinelektroden den Aufbau einer elektrischen Spannung bewirkten. GROVE konstruierte auch andere Batterien und nutzte sie zur Beleuchtung seiner Physikvorlesungen.
Diese ersten Brennstoffzelle war aber so ineffizient und von so kurzer Lebensdauer, dass sie mit Generatoren nicht konkurrieren konnten. Sie führten daher während des gesamten 19. und auch der ersten Hälfte des 20. Jahrhunderts nur ein Schattendasein. Allerdings wurde immer wieder versucht, sie zu verbessern. Um 1890 entwickelten die englischen Chemiker LUDWIG MOND und CARL LANGER eine Brennstoffzelle, bei welcher der (flüssige) Elektrolyt durch einen porösen Festkörper gehalten wurde; die poröse Oberfläche erleichterte auch den Kontakt zwischen Brennstoff und Elektrolyt. In den 1920er Jahren experimentierten unter anderem die deutschen Chemiker FRITZ HABER und WALTHER NERNST mit Brennstoffzellen, ohne jedoch einen Durchbruch zur Praxistauglichkeit zu erreichen.
Entwicklungsimpulse durch Raumfahrt und Treibhauseffekt
Nach Vorarbeiten durch britische und sowjetische Wissenschaftler in den 1930er Jahren gelangte die Brennstoffzelle nach dem Zweiten Weltkrieg wieder mehr und mehr in den Mittelpunkt des Interesses der Forschung. Der Grund hierfür waren einerseits Fortschritte in der Materialwissenschaft und Elektrochemie, welche effizientere und haltbarere Zellen ermöglichten. Andererseits suchte man im Kalten Krieg während des „Wettlaufs zum Mond“ (1961-1969) und des Wettrüstens zwischen den USA und der Sowjetunion nach Stromquellen mit langen Betriebsdauern, zum Beispiel für Raketen, Satelliten oder U-Boote. Die erste praktische Anwendung von Brennstoffzellen war die Stromversorgung der US-amerikanischen Gemini-Weltraummissionen ab 1963. Auch die Raketen des Apolloprogramms, mit denen 1969 erstmals Menschen zum Mond flogen, sowie die Space Shuttle wurden mit Brennstoffzellen ausgerüstet.
Im Laufe der 1970er Jahre gelangte der zusätzliche, vom Menschen verursachte Treibhauseffekt in zunehmendem Maße ins öffentliche Bewusstsein. Seitdem wird verstärkt an der Entwicklung von Brennstoffzellen für die allgemeine Stromversorgung und auch als Fahrzeugantrieb geforscht; Brennstoffzellen, die mit Wasserstoff und Sauerstoff betrieben werden, erzeugen nämlich lediglich Wasser oder Wasserdampf als Abgas. Bis Ende der 1990er Jahre konnte sich noch keine Anwendung der Brennstoffzellen am Markt durchsetzen, der kommerzielle Einsatz dieser Technologie wird jedoch für das Jahr 2005 prognostiziert.
-
Brennstoffzellen-Diagramm
Ser_igor - GettyImages
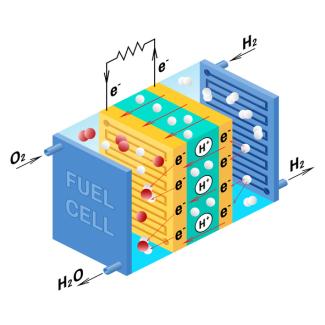
Aufbau und Wirkungsweise von Brennstoffzellen
Brennstoffzellen unterscheiden sich von elektrischen Batterien (Primärelementen) und Akkumulatoren dadurch, dass bei ihnen die Materialien, die Elektronen abgeben (Reduktionsmittel, Brennstoff) beziehungsweise aufnehmen (Oxidationsmittel), kontinuierlich zu- und abgeführt werden. In Batterien dagegen werden diese Materialien einmalig verbraucht, und bei Akkumulatoren werden sie in einem Ladevorgang regeneriert, der von der Nutzung als Spannungsquelle zeitlich getrennt ist.
Die bei einer Brennstoffzelle ablaufenden Reaktionen lassen sich mit den Vorgängen bei der bekannten Knallgasreaktion vergleichen:
Wasserstoff und Sauerstoff vereinigen sich unter Energieabgabe zu Wasser. Der entscheidende Unterschied zur Knallgasreaktion, die mit einer Explosion verbunden ist, besteht darin, dass die Reaktionen räumlich getrennt ablaufen und die Energie nicht unkontrolliert in Form von Wärme, sondern kontrolliert als elektrische Energie abgegeben wird.
Die Anode wird mit dem Brennstoff, meist Wasserstoff, und die Katode mit Sauerstoff versorgt. Der Elektrolyt verbindet die beiden Elektroden miteinander. Bei einer Betriebstemperatur zwischen 80 °C und 1000 °C gibt Wasserstoff an der Anode (Minuspol) Elektronen ab:
Die frei gewordenen Elektronen fließen über einen Verbraucher zur Katode und können dabei Arbeit verrichten.
An der Katode nimmt Sauerstoff Elektronen auf. Sauerstoff-Ionen bewegen sich durch den Elektrolyten zur Anode und vereinigen sich dort mit Wasserstoff-Ionen zu Wasser:
Die Dissoziationsreaktion, also die „Verbrennung“ des Wasserstoffs, findet an der Anode, die Bildungsreaktion, also die Entstehung von Wasser, an der Katode statt. Zwischen beiden Elektroden befindet sich ein spezieller Elektrolyt, in dem - wie im Fall der Niedertemperaturbrennstoffzelle - die positiven Wasserstoff-Ionen zur Katode transportiert werden können, der jedoch für Elektronen und neutrale Gase undurchlässig ist.
Bei Hochtemperaturbrennstoffzellen dagegen wandern die negativ geladenen Sauerstoff-Ionen zur Anode.
Weil in der Brennstoffzelle chemische Energie nicht in Wärme, sondern in elektrische Energie verwandelt wird, kann man die Vorgänge in der Brennstoffzelle als „kalte Verbrennung“ bezeichnen.
Katalysatoren und Elektrolyten
Eine große Schwierigkeit bei der Realisierung einer Brennstoffzelle liegt darin, dass die Reaktionen an Anode und Katode stark temperaturabhängig sind und bei Zimmertemperatur nur unter Einsatz eines geeigneten Katalysators in der erforderlichen Geschwindigkeit ablaufen. Ein guter Katalysator zeichnet sich dadurch aus, dass er sich selbst während der durch ihn geförderten Reaktionen nicht verändert und dass er eine große Fläche anbietet, auf der die Reaktionen ablaufen können. Als Elektrodenmaterial verwendet man meist Kohle, die mit einem katalytisch wirksamen Metall, zum Beispiel Platin, Palladium oder Nickel, überzogen ist. Die Elektroden sind porös, sodass sie eine große spezifische Oberfläche und dadurch einen guten Kontakt mit dem Elektrolyten und den zugeführten Betriebsgasen besitzen. Die Elektroden dienen aber nicht nur als Katalysator, sie müssen auch gemeinsam mit dem Elektrolyten verhindern, dass sich das Brennstoff- und das Oxidationsmittelgas „kurzschließen“, das heißt in einer explosiven Reaktion direkt miteinander reagieren. Als Elektrolyten werden Natron- oder Kalilauge, Phosphorsäure, geschmolzenes Calciumcarbonat oder festes Zirkondioxid verwendet - fast alle sehr aggressive Stoffe, wodurch hohe Anforderungen an die Beständigkeit der sonstigen in der Zelle eingesetzten Materialien gestellt sind. Dies gilt vor allem bei Mittel- und Hochtemperaturzellen, deren Arbeitstemperaturen bei 200 °C -1000 °C liegen.
Reformierung
Reines Wasserstoffgas und reines Sauerstoffgas sind aus Sicherheits- und Kostengründen als Betriebsstoffe für Brennstoffzellen nicht unbedingt vorteilhaft, vor allem Wasserstoff ist nicht nur hoch entzündlich, sondern auch schwierig zu lagern: Wasserstoff ist das kleinste Molekül und kann daher durch viele ansonsten „dichte“ Behältermaterialien hindurch diffundieren. Außerdem besitzt der gasförmige Wasserstoff eine mehr als zehntausend Mal geringere Dichte als Wasser, daher sind Wasserstofftanks entweder sehr groß oder stehen unter hohem Druck, was den Umgang mit ihnen noch gefährlicher macht. Und schließlich gibt es praktisch keine Infrastruktur zur flächendeckenden Versorgung mit Wasserstoff, was für den Einsatz der Brennstoffzelle als Fahrzeugantrieb eine notwendige Voraussetzung wäre.
Um dieses Problem zu umgehen, wurde ein Reformierung genanntes Verfahren entwickelt. Darunter versteht man die Abspaltung von Wasserstoff aus Kohlenwasserstoffen, etwa Alkohol (Methanol) oder Erdgas (Hauptbestandteil: Methan) innerhalb oder außerhalb der Zelle. Der Vorteil dieses Verfahrens besteht darin, dass anstatt des teuren und gefährlichen Wasserstoffgases flüssiger Alkohol oder das preiswerte Erdgas als Betriebsstoff zugeführt werden kann. Nachteilig ist, dass die Reformierung Energie verbraucht, wodurch die Effizienz der Zelle herabgesetzt wird.
Die Versorgung mit Sauerstoffgas ist wesentlich weniger problematisch als die mit Wasserstoff. Sauerstoff hat einen Anteil von etwa 20 % an der Erdatmosphäre. Die meisten Brennstoffzellentypen können Luftsauerstoff verarbeiten.
Wirkungsgrad von Brennstoffzellen
Eine wichtige Größe zur Charakterisierung der Effizienz eines Energiewandlers ist sein Wirkungsgrad. Darunter versteht man das Verhältnis von erzeugter elektrischer zu aufgewandter chemischer Energie. Während etwa Solarzellen Werte von höchstens 20% und ein Ottomotor einen Wirkungsgrad von 25% (Dieselmotor bis 40%) erreicht, liegt der Wirkungsgrad von Brennstoffzellen zwischen 40% und 65%. Durch die Brennstoffreformierung wird er zwar reduziert, jedoch wird dieser Nachteil aufgewogen durch deutliche Einsparungen bei Transport und Lagerung des Brennstoffs. Mithilfe von Brennstoffzellen lässt sich darüber hinaus der Wirkungsgrad anderer Energiewandlungsanlagen kräftig steigern. So können Hochtemperaturbrennstoffzellen in Blockheizkraftwerken eingesetzt werden, deren Prozesswärme die Voraussetzung für den Betrieb der Brennstoffzellen liefert. Diese wandeln zugeführte chemische Energie (Wasserstoff und Sauerstoff) in elektrischen Strom um, wodurch der Wirkungsgrad der Gesamtanlage auf 70% - 80% anwächst - weit mehr als die knapp 60%, die moderne Gaskraftwerke erreichen.
Brennstoffzelltypen
Eine Einteilung der verschiedenen bisher entwickelten Varianten der Brennstoffzelle erfolgt meist nach der Betriebstemperatur. Niedertemperaturbrennstoffzellen haben Betriebstemperaturen von unter 100 Grad Celsius. Damit in diesem Temperaturbereich eine ausreichend hohe Reaktionsgeschwindigkeit erreicht wird, müssen die Elektroden mit einem Katalysatormaterial beschichtet sein.
Zu den Niedertemperaturbrennstoffzellen zählt vor allem die alkalische Brennstoffzelle (AFC, alkaline fuel cell). Dieser Typ mit einer Betriebstemperatur von 80 °C bis 90 °C benutzt Wasserstoffgas als Brennstoff sowie Sauerstoff oder Luft als Oxidationsmittel. Namensgebend ist der Elektrolyt, eine alkalische Lauge wie Natron- oder Kalilauge. Da die starke Elektrolytlauge die meisten Polymere und viele andere Stoffe angreift, ist die Konstruktion langlebiger AFCs nicht einfach. Sie werden jedoch seit Jahren mit Erfolg im Space Shuttle eingesetzt, und zwar nicht nur zur Strom-, sondern auch zur Wasserversorgung!
Bei 60 °C -80 °C wird die Polymer-Elektrolytmembran-Brennstoffzelle (PEMFC) betrieben. Der Elektrolyt besteht aus einer dünnen, Protonen (also Wasserstoff-Ionen) leitenden Membran aus Perfluorosulfonsäure (Handelsname Nafion) oder einem anderen Polymer-Ionenleiter, welche sich zwischen zwei ebenfalls flach ausgeführten Elektroden befindet. Eine Zelleneinheit besteht aus vielen hintereinandergeschalteten Membran-Elektroden-Kombinationen.
Beide Niedertemperaturzellen eignen sich prinzipiell für die Anwendung als Fahrzeugantrieb, jedoch muss wegen der niedrigen Betriebstemperatur eine Reformierung extern erfolgen, oder es muss reiner Wasserstoff getankt werden.
Mitteltemperaturbrennstoffzellen arbeiten bei 100 °C bis 600 °C. Ein Beispiel dafür ist die Phosphorsäure-Brennstoffzelle (PAFC, phosphoric acid fuel cell). Die Kohleelektroden tragen eine Katalysatorbeschichtung, der Elektrolyt ist Phosphorsäure. Die poröse Stützstruktur, welche den flüssigen Elektrolyten enthält, besteht aus Grafit, was die Gesamtkosten beträchtlich erhöht. Phosphorsäurezellen können mit Wasserstoff, der Kohlenstoffdioxid enthält, oder reformiertem Methan betrieben werden.
Hochtemperaturbrennstoffzellen arbeiten bei 500 °C -1000 °C, zum Teil auch darüber. Zwei Typen von Brennstoffzellen dominieren zurzeit im Hochtemperaturbereich: die Schmelzcarbonat- und die Festkeramik-Brennstoffzelle. Die Schmelzcarbonat-Brennstoffzelle (MCFC, molten carbonate fuel cell) hat geschmolzenes Calcium- oder Kaliumlithiumcarbonat als Elektrolyt, die Betriebstemperatur liegt bei 650 °C. Als Brennstoff dient eine Mischung aus Wasserstoff und Kohlenmonoxid, das aus Wasser und einem fossilen Energieträger (z.B. Erdöl) gewonnen wird. Im Betrieb verbinden sich zunächst die Carbonationen des Elektrolyten mit Wasserstoff und Kohlenmonooxid und bilden dann mit dem zugeführten Sauerstoff Wasser und Kohlendioxid. Als Strukturmaterialien für Pumpen, Lager und Ähnliches werden Metalle und Spezialkunststoffe benutzt, wodurch dieser Zelltyp zwar dreimal teurer als AFCs, jedoch immer noch preiswerter als PAFCs ist. Neben den hohen Temperaturen stellt auch die Tatsache, dass Kohlenmonooxid ein starkes Atemgift ist, die Ingenieure vor Probleme.
Mit 850 °C -1000 °C benötigt die Festkeramik-Brennstoffzelle (SOFC, solid oxide fuel cell) die höchsten Betriebstemperaturen. Als Elektrolyt dient das feste keramische Zirkondioxid. Anders als in den Protonen leitenden sauren und alkalischen Flüssigelektrolyten wandern hier Sauerstoff-Ionen durch den Festelektrolyt von der Kathode zur Anode. Das passiert allerdings nur bei den genannten hohen Temperaturen, weswegen für den Betrieb einer SOFC von außen Wärme zugeführt werden muss. Hochtemperaturbrennstoffzellen sollen zum Beispiel in Verbindung mit Heizkraftwerken eingesetzt werden, durch deren Abwärme sie auf Betriebstemperatur gebracht werden können. Dadurch verschlechtert sich zwar die Energiebilanz, andererseits könnte bei den hohen Temperaturen die Reformierung besonders effektiv genutzt werden, sie könnte nämlich ohne weitere Energiezufuhr vor Ort, also innerhalb einer Zelle, erfolgen.
Anwendungen: Autos, Raumfahrzeuge und Kraftwerke
Für alle Anwendungen der Brennstoffzelle gilt es zwei physikalisch bedingte Hindernisse zu überwinden: Zum einen beträgt die theoretisch maximal mögliche elektrische Spannung, die von einer einzelnen Zelle abgegeben werden kann, je nach Typ nur etwas über ein Volt (reine Wasserstoff/Sauerstoffzelle bei 25 Grad Celsius und Normaldruck: 1,23 Volt). Im Betrieb liegen die realen Zellspannungen einzelner Elemente zwischen 0,5 und 0,9 Volt. Daher muss man für praktisch alle Anwendungen eine größere Zahl von Einzelelementen zu Stapeln oder Stacks hintereinanderschalten. Auf diese Weise erreichen dann allerdings größere Einheiten Spannungen bis in den Kilovoltbereich hinein.
Das zweite Hindernis besteht darin, dass Brennstoffzellen wie alle galvanischen Elemente Gleichstrom liefern, der mit einem Konverter in den üblicherweise benötigten Wechselstrom umgewandelt werden muss.
Ebenfalls für alle Varianten gilt, dass es sich um komplexe technische Systeme handelt, die neben dem eigentlichen Spannung erzeugenden Element viele weitere Komponenten enthalten (z.B. Pumpen, Gebläse, Zu- und Abführungen für die Reaktionsprodukte, Brennstoffspeicher sowie eine große Zahl von Sensoren und Stellgliedern, mit denen der sichere Betrieb einer Zelleneinheit überwacht und gewährleistet werden kann).
Fahrzeugantrieb: Relativ weit entwickelt ist der Einsatz der Brennstoffzelle - in Verbindung mit einem Elektromotor - zum Antrieb von Personen- und Nutzfahrzeugen. Pionier dieser Entwicklung war der Daimler-Benz-Konzern (seit 1998: Daimler-Chrysler), der 1994 das Versuchsfahrzeug Necar-I (New Electric Car), einen Kleintransporter, vorstellte, der mit einer Niedertemperatur-PEM-Brennstoffzelle ausgestattet war. Im März 1999 wurde der auf der A-Klasse basierende Necar-4 präsentiert, nach Firmenangaben der erste emissionsfreie Brennstoffzellenpersonenwagen; er hat eine Leistung von 56 Kilowatt und erreicht über 100 km/h Höchstgeschwindigkeit. Auch andere Fahrzeughersteller arbeiten an entsprechenden Antriebsystemen.
Allerdings sind nur rein Wasserstoff betriebene Brennstoffzellenfahrzeuge wirklich emissionsfrei, Fahrzeuge, die reformierte Kohlenwasserstoffe verwenden, emittieren das Treibhausgas Kohlendioxid, wenn auch in deutlich geringerem Ausmaß als herkömmliche Verbrennungsmotoren. Welches der beiden Konzepte sich langfristig durchsetzen wird - entweder emissionsfrei, aber Aufbau einer Wasserstoffinfrastruktur, oder niedrige Kohlendioxidemission unter Nutzung der bestehenden Tankstelleninfrastruktur -, kann heute noch nicht abgesehen werden. Die geringen oder verschwindenden Schadstoffemissionen sind nicht der einzige Vorteil des Brennstoffzellenantriebs: Er ist lärmarm, nahezu vibrationsfrei, sehr wartungsfreundlich und hat, aufgrund des hohen Wirkungsgrads, einen sehr niedrigen Verbrauch. Der größte Nachteil ist die Gefahr einer Explosion des Wasserstofftanks bei Unfällen sowie die noch relativ geringe Reichweite.
Kraftwerke: Die zweite kommerziell aussichtsreiche Anwendung der Brennstoffzelle ist die Stromerzeugung in Großkraftwerken oder lokalen Blockheizkraftwerken. Für große Anlagen bieten sich Hochtemperaturzellen auf der Basis von Feststoffkeramikelektrolyten (SOFC) an, die mit der in einem Kraftwerk anfallenden Prozesswärme auf Betriebstemperatur gebracht werden können.
In Berlin-Treptow wird seit Mitte 1999 ein Blockheizkraftwerk mit einem PEMFC-Testaggregat betrieben. Es liefert 250 Kilowatt Strom und 230 Kilowatt Wärme. In Essen ist eine Demonstrationsanlage mit 300 Kilowatt Leistung im Jahr 2000 in Betrieb gegangen.
Raumfahrt: Das erste und am längsten erprobte Einsatzgebiet der Brennstoffzelle ist die Raumfahrt. AFCs haben viele, vor allem bemannte Raummissionen begleitet. Der Space Shuttle besitzt drei 92 Kilogramm schwere Brennstoffzelleneinheiten mit je 14 Kilowatt Leistung. Gleichzeitig produziert die Anlage sieben Liter Wasser pro Stunde. Der Wirkungsgrad der in der Raumfahrt benutzten Niedertemperaturzellen liegt mittlerweile bei über 80%.
Solare Wasserstoffwirtschaft
Brennstoffzellen allein lösen trotz ihrer vielen Vorteile nicht das Problem der Klimaerwärmung durch die Verstärkung des natürlichen Treibhauseffekts. Die entscheidende Frage ist, auf welche Weise der Wasserstoff als Brennstoff gewonnen wird. Geschähe dies auf herkömmliche Weise durch Elektrolyse mit Strom aus Kohlekraftwerken, so würde die Kohlendioxidemission nur von der Brennstoffzelle in das Kraftwerk verlagert. Daher spielt in heutigen Szenarien für eine globale nachhaltige Energiewirtschaft die solare Wasserstoffwirtschaft eine große Rolle. Diese verbindet die Stromerzeugung aus Wasserstoff mit der Gewinnung von Wasserstoff durch Ausnutzung der Sonnenenergie. Der Strom, der für die Erzeugung von Wasserstoff aus Wasser benötigt wird, könnte beispielsweise fotovoltaisch, also mit Solarzellen, gewonnen werden. Die Hauptschwierigkeit der Wasserstoffwirtschaft ist der sichere Transport und die Lagerung von großen Mengen von Wasserstoff, sollte dieser zum Hauptenergieträger der Weltwirtschaft werden. Die hierzu notwendigen Entwicklungskosten sollten aber durch die Vorteile einer praktisch unerschöpflichen und klimaverträglichen Energiequelle mehr als aufgewogen werden.
Suche nach passenden Schlagwörtern
- Brennstoff
- Anode
- Katode
- Mitteltemperaturbrennstoffzellen
- Space Shuttle
- Stacks
- Raumfahrt
- Betriebstemperatur
- Akkumulatoren
- Wasserstoff
- Hochtemperaturbrennstoffzellen
- Batterien
- Kraftwerke
- Elektrolyt
- Wirkungsgrad
- Treibhauseffekt
- Volta
- galvanisches Element
- Reformierung
- Stapel
- Niedertemperaturbrennstoffzellen
- Brennstoffzelltypen
- Blockheizkraftwerk
- Sauerstoff
- Fahrzeugantrieb
- Brennstoffzellen
- WILLIAM ROBERT GROVE
- Katalysator
- Galvani

